1. BALON CONTRAPULSACIÓN AÓRTICO
El balón de contrapulsación intraaórtico (BCPIA) es el dispositivo que permite la asistencia coronaria de corta duración que es más utilizado en la actualidad debido a su fácil manejo y funcionamiento, así como a sus excelentes resultados.
Como función principal se define para aumentar la circulación de la sangre durante la fase diastólica. La forma de conseguirlo es llenando el balón que se coloca en la aorta, de forma sincronizada con el corazón, durante la fase de relajación o diástole.
Al hacer esto, aumentamos la presión arterial diastólica y conseguimos que aumente la circulación coronaria y, como consecuencia, ayudamos a mejorar la función del corazón, cuando es necesario.
El mecanismo básico para crear asistencia coronaria por el cual realiza su efecto consiste en un desplazamiento de volúmenes produciendo asi un descenso de la postcarga del ventrículo izquierdo (VI), y da como resultado una disminución del trabajo cardíaco, del consumo de oxígeno del miocardio y, por tanto, se deriva a un aumento de la presión diastólica que va a permitir mejorar la perfusión coronaria a nivel proximal y la perfusión periférica a nivel distal.
Desde el punto de vista del tipo de asistencia, se debe considerar como una asistencia en serie que requiere obligatoriamente la actividad del ventrículo y que provoca un aumento limitado del volumen de eyección.
Descripción y funcionamiento
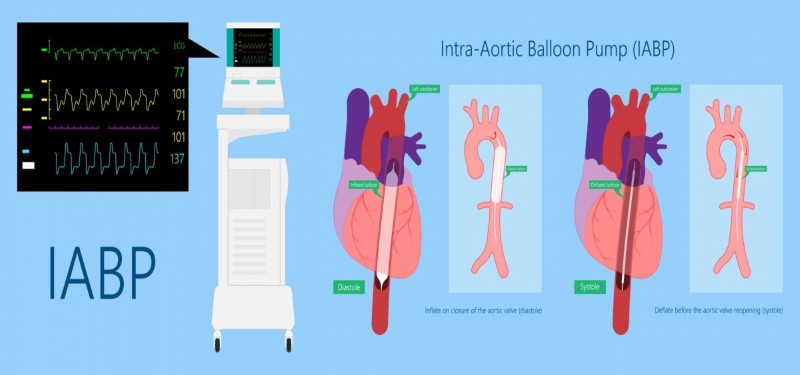
Es un balón premontado e hinchable, que va insertado sobre un catéter, y que se coloca en la aorta torácica descendente a unos 2 cm. distal a la subclavia izquierda.
Su inflado y desinflado se realiza con gas comprimido que tiene la consola base y, está sincronizado con el ECG del paciente y/o su presión arterial.
Cuando el balón se sincroniza con el electrocardiograma, lo hace con las ondas R y T. La onda R coincide con la sístole ventricular para el desinflado y la onda T es el índice eléctrico de la diástole para el inflado.
BCPIA
Al abrirse la válvula aórtica que se realiza durante la sístole, el balón colocado se acaba de desinflar, y provoca una reducción súbita y significativa de la PA facilitando la inyección ventricular. Al reducir la postcarga, se reduce el estrés de la pared ventricular y el consumo miocárdico de oxígeno.
Al cerrarse la válvula aórtica, es decir, durante la diástole se infla el balón, aumentando así la presión arterial y desplaza la sangre aumentando el flujo coronario, aumentando levemente el débito cardíaco.
Antes de la inserción del balón en Aorta, es muy importante asegurarse de elegir el tamaño adecuado para el paciente, existen diferentes modelos que dependerán de las recomendaciones comerciales según la talla del paciente y está disponible en varios volúmenes, principalmente de 30, 40 y 50cc.
Asimismo, también hay que recordar que, una vez inflado, el tamaño del balón no debe exceder del 80-90% del diámetro de la aorta descendente.
En la actualidad dicho procedimiento se realiza en las salas de Hemodinámica, bajo fluoroscopia, el catéter se inserta por vía percutánea en la arteria femoral, aunque también puede insertar de manera percutánea a través de la arteria braquial.
Una vez introducido, se debe colocar en la aorta descendente, con la punta que es radiopaca a unos 2-3cm por debajo de la arteria subclavia izquierda.
Dependiendo de la hemodinámica del paciente en el momento, los ciclos del BCPIA se pueden programar cada ciclo cardíaco del paciente o espaciarse (1:2, 1:4, 1:8) según la frecuencia cardíaca del paciente.
Asimismo, el destete del aparato debe realizarse mediante la disminución en el ritmo de ciclado.
El balón ha de mantenerse contrapulsando hasta su retirada, no puede estar parado más de 15 min. Es importante mantenerlo con heparina para no coagularse el catéter.
Indicaciones
El BCPIA está indicado para pacientes con fallo ventricular izquierdo o en diagnóstico de shock cardiogénico que no responden al tratamiento farmacológico y en los que existe una lesión potencialmente reversible. La finalidad del dispositivo es proporcionar apoyo circulatorio hasta que se resuelva la fase aguda de isquemia cardíaca o de fallo cardiaco.
Contraindicaciones
El BCPIA está contraindicado ante la presencia de insuficiencia aórtica, ya que empeora la regurgitación.
Por otra parte, no debe ser colocado en pacientes con sospecha o certeza de disección aórtica ya que su colocación en la falsa luz puede desembocar en el aumento de la disección o incluso en rotura aórtica.
La existencia de aneurismas abdominales de gran tamaño puede facilitar la rotura de la aorta a este nivel.
La inserción percutánea del BCPIA debe evitarse en pacientes con enfermedad vascular periférica grave, ya que puede precipitar la trombosis intravascular o la embolia con isquemia de la extremidad.
Y también, aunque no es contraindicación absoluta, la colocación de un BCPIA debe ser cuidadosamente valorada en pacientes con septicemia o alteraciones graves de la coagulación. Se valorará en estos casos el factor riesgo/beneficio para el paciente.
Cuidados de enfermería durante y después del procedimiento
- Los cuidados de enfermeria durante todo el proceso de colocación y sus cuidados pre y post colocación asi como su retirada, irán encaminados hacia el bienestar del paciente y proporcionar las medidas necesarias para disminuir su ansiedad delante del procedimiento desconocido para este.
- Explicaremos el procedimiento y las posibles sensaciones que puede experimentar, desde la punción hasta su funcionamiento.
- Escuchar las preocupaciones del paciente y resolver sus dudas.
- Vigilar y realizar el control de infecciones.
- Monitorización respiratoria y signos vitales.
Los cuidados Post-procedimento:
- Reposo absoluto en cama con cambios posturales según protocolo hospitalario
- Monitorización de constantes vitales
- Evaluar posicionamiento del catéter comprobando la posición de la consola con determinación analítica constane de hemograma y coagulación (riesgo de trombosis de catéter)
- Control de la existencia de sangrado o hematoma
- Evaluar punto de inserción femoral, pulsos distales, coloración y temperatura de la extremidad afectada.
2. MARCAPASOS TEMPORAL
El marcapasos temporal o transitorio se puede definir como un dispositivo electrónico que permite iniciar las contracciones miocárdicas cuando la estimulación propia del corazón es insuficiente, ya sea por falta de conducción de los impulsos eléctricos o porque la frecuencia sea demasiado baja para mantener un gasto cardíaco adecuado
Dispositivo marcapasos interno
Indicaciones
-
En infarto agudo de miocardio. Las indicaciones para el marcapasos en este contexto incluyen el desarrollo de un nuevo bloqueo de rama de novo.
-
En caso de Bradicardia. El marcapasos temporal está indicado en paciente con bradicardia hemodinámicamente significativa.
-
Se indica para sobreestimular y acabar un flúter auricular, taquicardia supraventricular y taquicardia ventricular monomórfica sostenida.
-
Como tratamiento puente hasta implantación de marcapasos permanente en paciente con bloqueo AV comppleto, bloqueo de segundo grado y disfunción sinusal severa.
-
En casos de Taquicardia ventricular
-
Miocarditis
-
de manera profiláctica, en procedimientos de intervencionismos con riesgo.
Contraindicaciones
- Paciente con problemas de acceso vascular
- Coagulación con INR
Descripción y funcionamiento
El marcapaso transitorio está formado por un generador con el que se pueden establecer los siguientes parámetros:
2.1 Intensidad de salida (Output)
Una vez colocado el catéter de marcapasos, la persona circulante comienza a elevar la intensidad hasta que aparece en el monitor de registro cardíaco la espícula originada por él, seguida por un QRS ancho, que será indicativo propio de una estimulación ventricular. La intensidad necesaria para que se desencadene este complejo se denomina umbral de excitación. Generalmente, cuando un marcapasos interno está situado, el umbral de excitación es inferior a 1 mA.
Seguidamente elevaremos la intensidad hasta el doble del umbral para garantizar que en ningún caso será insuficiente. No es conveniente subirla más del doble porque corremos el riesgo de dañar la pared cardíaca.
2.2. Frecuencia cardiaca
Se define como el valor que representa el número de veces que el marcapasos funciona por minuto. Si éste mantiene un ritmo aceptable en el paciente, estableceremos una frecuencia sobre 50 sístoles por minuto, para que no interfiera en la actividad cardíaca. Si el paciente no es capaz de mantener una frecuencia suficiente se debe subir la frecuencia para conseguir un gasto cardíaco adecuado.
Es importante saber que el hecho de estimular únicamente el ventrículo, el volumen de eyección se ve reducido en un 20% como consecuencia de la falta de aporte auricular. El incremento más significativo del gasto se produce con frecuencias de 80- 90 impulsos /min. Pero esto eleva el consumo de oxígeno a nivel de miocardio, por lo que, generalmente, no se debe sobrepasar frecuencias de 70- 80 impulsos/min.
2.3. Sensibilidad
Se encarga de regular la eficiencia del marcapasos para detectar la actividad eléctrica intrínseca. Su medida es en milivoltios y se ajusta para permitir que el marcapasos controle por demanda, es decir cuando no perciba actividad electrica.
El generador del marcapasos genera una corriente que se transmite por el electro-catéter y llega hasta el electrodo, al entrar en contacto directo con el corazón del paciente. Este estímulo produce la despolarización miocárdica y posteriormente, el estímulo vuelve al generador y completa así el circuito eléctrico. El electrocatéter puede ser intravenosos o epicárdico.
La estimulación temporal transvenosa es la forma más habitual que se utiliza y se realiza mediante punción en vena yugular interna derecha, de la vena subclavia derecha o de la vena femoral, y se dirige el electrodo al ventrículo derecho.
2.4. Cuidados de enfermería
Valorar el estado actual del paciente para evitar y/odetectar precozmente las posibles complicaciones intra o postoperatorias.
Valorar conocimiento del paciente acerca del procedimiento y su estado emocional.
Comprobar vía venosa permeable para el procedimiento.
Monitorización de las constantes vitales.
Una vez implantado se debe examinar la zona de punción del atéter como minimo una vez al dia, prevenir signos de infección y tapado con apósito estéril, al igual que el procedimiento que debe ser lo mas esteril posible
Se realizará ECG de 12 derivaciones a diario
Comprobar la función del marcapasos diariamente, determinando los umbrales de sensibilidady estimulación, así como el ritmo basal del paciente, disminuyendo la frecuencia de estimulación gradualmente hasta el cese.
Complicaciones
- La colocación de un marcapasos transitorio puede estimular músculos, en ocasiones esto puede generar dolor, será necesario desplazar el electrodo para alejarlo del músculo pectoral sin alterar el control del ritmo cardíaco para minimizarlo.
- Desplazamiento del electrocatéter provocando trastornos del ritmo
- Infecciones tanto durante como post procedimiento.
- Neumotórax
- Latidos ectópicos
- Perforación de la pared del miocardio y taponamiento cardíaco que pueden llegar a comprometer la vida del paciente.
3. HIPOTERMIA CONTROLADA
La hipotermia controlada terapéutica se define como la aplicación de frío, con el objetivo de disminuir de forma controlada la temperatura corporal, entre 32 y 34ºC durante un periodo de 12 a 24 horas, disminuyendo de esta forma, las alteraciones neurológicas secundarias al paro cardiaco, el consumo de oxígeno a nivel cerebral y los requerimientos metabólicos, entre un 6 y un 7% aproximadamente por cada grado que disminuye la temperatura corporal.
El control de la temperatura corporal en un estado de hipotermia tiene como ventajas el favorecer la neuroprotección debido a varios factores:
• Disminuye los procesos que producen una muerte celular de manera que se reduce la liberación de aminoácidos excitadores y radicales libres.
• Reducción del metabolismo cerebral para mejorar la relación de aporte y consumo de oxígeno favoreciendo las áreas isquémicas.
• Antagonista del calcio disminuyendo la lesión celular.
• Modulación de la respuesta inflamatoria y de la apoptosis neuronal.
• Bloqueo de mecanismos excitotóxicos como es la liberación de radicales libres.
• Preservación de la síntesis proteica.
• Disminución del edema neurogénico.
Para conseguir dicha temperatura, se utilizan dos métodos los llamados intravasculares y los superficiales. Siendo el primero más rápido y eficaz a la hora de obtener la temperatura, pero no hay una evidencia clara sobre que método es mejor por ello ambos métodos son utilizados para obtener una reducción de la hipotermia.
Además, durante todo el proceso es importante tener un control de la temperatura y de los efectos adversos que se pueden producir siendo los más comunes los temblores, infecciones, arritmias…
La hipotermia terapéutica se lleva a cabo en cuatro fases:
-
Inducción.
-
Mantenimiento.
-
Recalentamiento o Rewarming.
-
Estabilización térmica.
El objetivo de la fase de inducción es hacer que el paciente alcance una temperatura entre 32 y 34ºC, descendiendo entre 1 y 1´3ºC por hora, ya que se considera un equilibrio entre los beneficios clínicos y los efectos secundarios, que se ven agravados a temperaturas más bajas.
La Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) recomienda llevarla a cabo en los primeros 20 minutos, incluso en el medio extrahospitalario, ya que mejora de forma significativa la supervivencia y pronóstico neurológico de los pacientes, aunque a veces no es posible tener acceso a este tipo de terapia extrahospitalaria.
La velocidad de descenso de temperatura siempre depende del método utilizado.
Actualmente hay varios métodos disponibles para realizar el enfriamiento, pero la administración de fluidos intravenosos, como suero fisiológico o Ringer Lactato, enfriados a 4ºC, es la técnica más empleada por su sencillez y rapidez, junto con la administración de bolsas de hielo colocadas en ingles, axilas, cuello y cabeza.
Estas técnicas son seguras y eficaces, pero tienen la dificultad de mantener la hipotermia, por lo que deben asociarse a otra técnica que mantenga al paciente con la temperatura deseada, como, por ejemplo, las mantas y colchones térmicos.
En la fase de mantenimiento, el objetivo es mantener una temperatura corporal entre 32 y 34ºC durante 12 a 24 horas con las mínimas diferencias térmicas. Posteriormente, en la fase de recalentamiento o rewarming, se aumenta la temperatura del paciente entre 0´2 y 0´4ºC a la hora, hasta alcanzar una temperatura corporal de 37ºC.
Por último, se debe lograr una estabilización térmica que consiste en mantener una normotermia controlada, en las 12 horas posteriores a alcanzar una temperatura corporal de 37ºC.
Se debe evitar la hipertermia ya que es un factor de riesgo asociado con una tasa muy alta de probabilidad de muerte.
El pronóstico del paciente que recibe tratamiento de hipotermia tras PCR, dependerá también de factores influyentes como el ritmo inicial desfibrilable, la edad del paciente, a menor edad mejor pronóstico, si la PCR ha sido o no presenciada y tiempo sin flujo coronario.
La hipotermia controlada no aumenta el riesgo ni el número de complicaciones en comparación con pacientes similares que no han sido tratados con hipotermia terapéutica; es importante recalcar que esta, no tiene efectos secundarios graves ni complicaciones asociadas a mortalidad, por lo que riesgo/beneficio esta bien diferenciado.
A pesar de que la hipotermia terapéutica se ha demostrado que mejora la supervivencia, calidad de vida y minimiza las secuelas de los pacientes recuperados tras una parada cardiaca, sólo se lleva a cabo la realizada de manera intravascular en muy pocas unidades de cuidados intensivos españolas, aunque su evolución en la expansión y puesta en marcha es muy favorable, esto es debido a la falta de formación en estas técnicas y la sobrecarga de cuidados que la hipotermia terapéutica conlleva, esto genera prescindir de ella.
Los numerosos cuidados y conocimientos que requieren este tipo de pacientes, tales como la canalización de catéteres venosos periféricos y centrales, el mantenimiento de los mismos, los cuidados de las vías aéreas, el manejo de la ventilación mecánica invasiva, el control de sedación y la monitorización de la misma, la monitorización de constantes vitales, la colocación y cuidados de la sonda vesical y de sistemas de monitorización hemodinámica, y además la realización de las técnicas para la inducción y mantenimiento de la hipotermia, generan a veces dudas o temores al personal de enfermería no habituado a este procedimiento, por lo que minimizaría estos temores la realización de un plan de cuidados de enfermería protocolarizado para facilitar la estandarización de los cuidados que requiere el paciente sometido a hipotermia terapéutica intravascular.
Pero siempre podremos aplicar las técnicas no invasivas conocidas en todos los centros hospitalarios y en atención pre-hospitalaria para iniciar y realizar la hipotermia terapéutica:
-
Mantas y Colchones con sistema de aire
-
Sistemas de agua circulantes
-
Almohadillad de Hidrogel
-
Uso de toallas frias….etc.
Su aplicación será distribuida en Frente, cuello, Axilas, Abdomen, Zona inginal principalmente.
BIBLIOGRAFÍA
-
Lahera Juliá, V; Garrido Astray, C. Sistema cardiovascular. En: Tresguerres, Jesús A.F; Villanúa Bernués, M.A.; López Calderón Barreda, A, editores. Anatomía y Fisiología del Cuerpo Humano. Madrid: McGraw-Hill/Interamericana de España; 2009. p. 111-41.
-
Gray, 2º tomo, Anatomía de Gray, 38ª edición, Editorial Harcout Brace, Madrid, 1998, pp. 700-744.
-
Testut, L; Latarjet, A; Tomo segundo, Tratado de anatomía humana, novena ed. Editorial Salvat Editores SA, Barcelona, 1971, pp. 4-154.
-
Bouchet, A Cuilleret, J, Tórax, Anatomía descriptiva y funcional, Editorial Médica Panamericana SA, 1979, pp. 150-229.
-
Monzón Martín D, Rubio Alcañiz V. Paciente portador de marcapasos. En: Guía de intervención rápida de enfermería en cuidados intensivos. 1ªed. Madrid: Difusión avances Enfermería; 2007.p.200-201
-
Manual of Cardiovascular Medicine. SP. Marso, BP. Griffin, E.J Topol. Capítulo51. Marcapasos temporal endovenoso.
-
Manual de procedimientos de enfermería en Hemodinámica y cardiología intervencionista. AEEC. Tema 47. Marcapaso Transitorio. V. Rubio, J. Suárez, M. Martel.
-
Garatti A, Russo C, Lanfranconi M, et al. Mechanical circulatory support for cardiogenic shock complicating acute myocardial infarction: an experimental and clinical review. ASAIO J. 2007;
-
Noel BM, Gleeton O, Barbeau GR. Transbrachial insertion of an intra-aortic balloon pump for complex coronary angioplasty. Catheter Cardiovasc Interv. 2003; 60:36-9.
-
Müllner M, Urbanek B, Havel C, et al. Vasopressors for shock. Cochrane Database Syst Rev 2004.
-
Martín-Hernández H, López-Messa J, Pérez-Vela J, Molina-Latorre R, Cárdenas-Cruz A, Lesmes-Serrano A, et al. Manejo del síndrome posparada cardíaca. Med Intensiva. 2010; 34(2):107-126.
-
Carcela Salvador T, Gutiérrez Macías Á, Macías Vaz AM. Enfriar a tiempo puede salvar la vida. Doc Enferm. 2014 Sep;(55):8-11.
-
Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. 346(2002), pp 557-563.
-
Barreña Oceja I, Gil Martín FJ, García de Vicuña Meléndez A, Rodríguez Delgadillo MÁ, Gutiérrez Herrador G, Vázquez Naveira MP. Resultados de la puesta en marcha de un protocolo de hipotermia terapéutica en la parada cardiaca consensuado entre un sistema de emergencias médicas y un servicio de urgencias hospitalario. Emergencias. 2012; 24(1):39-43.
-
A. Ristic, M. izmazio, A. Yehuda, A. Anastasakis, L.P. Badano, A. Brucato, et al. Triage strategy for urgent management of cardiac tamponade. Eu Hear J., 35(2014) pp 2279-2284
-
Lawin Peter. Cuidados intensivos. Barcelona: Salvat 2006
-
European Resuscitation Council 2015. Consejo de Resucitación Cardiopulmonar.
-
Miguel R de et al. Manual del cuso de Sindrome coronario Agudo. Diagnostico y tratamiento y cuidados de enfermeria. Madrid MC Graw Hill 2003
-
Yaraví FD. El gasto cardíaco; Disponible fcm.uncu.edu.ar/medicina
-
Serrano Poyato, C; Alonso Moreno, A. Garcia Rueda, S. Procedimientos intervencionistas percutáneos especiales. Pericardiocentesis. Capitulo VII. Tema 26.1 195-200 Asociación española de Cardiologia.
-
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med. 1999; 341: 625-34.
-
Gandhi SK, Powers JC, Nomeir AM, et al. The pathogenesis of acute pulmonary edema associated with hypertension. N Engl J Med. 2001; 344: 17-22.
-
Vega JA, Avilés F, Preparación del paciente y cuidados generales. Aribay V, Gómez M, Jimenez R, Santos S, Serrano C; Manual de enfermeria en cardiología y hemodinamica. Protocolos Unificados 2007,416 pp.
-
D’Ortencio AO, Lauga A, Perel C. Balón de contrapulsación intraaortico. Insuficiencia Cardíaca.2008; 3(4):184-195
-
Cuenca JJ, Fojón S. Manual de contrapulsación intraaortica. Barcelona. Edikamed; 2012.
-
Fuente Ramos M. Enfermería médico-quirúrgica. Col. Enfermeria S21. 3ed. Madrid: Difusión Avances de Enfermeria (DAE);2015
-
Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Böhm M, et al. Guía de práctica clínica de la ESH/ESC 2013 para el manejo de la hipertensión arterial. Rev.Esp. Cardiologia 2013; 66(11): 880.e1-e64.
-
Royo-Bordonada MA, Lobos Bejarano JM, Villar Álvarez F, Sans S, Pérez A, Pedro-Botet J, et al. Comentarios del Comité Español Interdisciplinario de Prevención Cardiovascular (CEIPC) a las guías europeas de prevención cardiovascular 2012. Rev. Esp. Salud Pública 2013; 87:103-20.
-
Álvarez, J. M., J. M. Maroto, y L. F. Arós. Guia del enfermo coronario. Madrid: Sociedad Espanola de Cardiologia, 2006.
-
María Cruz Martín Delgado, José Luis García Garmendia, María Paz Fuset Cabanes, Enrique Fernández-Mondéjar. Competencias profesionales y trabajo en equipo en pacientes con enfermedades cardiacas agudas y críticas.
Rev Esp Cardiol. 2016;69:63210.1016/j.recesp.2016.01.026
-
G.D. Perkins, et al., European Resuscitation Council Guidelines 2021: Executive summary, Resuscitation (2021) Traducción oficial al castellano del Consejo Español de RCP (CERCP)
-
Part 1: introduction to the International Guidelines 2000 for CPR and ECC . A consensus on science. European Resuscitation Council. Resuscitation 2000; 46:315, doi:http://dx.doi.org/10.1016/s0300-9572(00)00269-0.
