España ha desarrollado una actividad de donación y trasplante extraordinaria, fundamentada básicamente en la donación de órganos en muerte encefálica (ME), y cuenta con medidas de índole organizativo, legislativo y político, y el soporte sanitario necesario, todas ellas encaminadas de optimizar la identificación de donantes potenciales y convertirlos en donantes reales.
Sin embargo, la reducción de la mortalidad en situaciones compatibles con la donación en ME, como son la reducción de mortalidad por accidentes de tráfico o enfermedades cerebrovasculares, y el aumento de supervivencia de pacientes críticos y neurocríticos, contribuyen a que el potencial de donación en muerte encefálica sea cada vez más insuficiente para cubrir la demanda de órganos de nuestro país. Si le añadimos el cambio que se produce en el perfil del donante en ME, siendo estos donantes más añosos y con más comorbilidades (DCE), hace que progresivamente sea un proceso de menor rentabilidad y con menor expectativas de éxito.
La donación en asistolia, en nuestro país, arranca en la década de los 80 con experiencias aisladas en Madrid, Barcelona y A Coruña, gracias a una estrecha colaboración entre los servicios de emergencias y los coordinadores de trasplantes.
Pero es a partir de 2012, con el Documento de Consenso Nacional de Donación en Asistolia, y a través de un programa en el que se requiere la colaboración de médicos de distintas especialidades, tanto intra como extrahospitalarios, de los coordinadores de trasplantes, y de jueces y forenses, cuando este tipo de donación se convierte en una práctica habitual en nuestros hospitales, hasta el punto de que, en la actualidad, uno de cada cuatro donantes lo es en DA.
La donación en asistolia forma parte del Plan Estratégico de la ONT para aumentar el índice de trasplantes. Y a pesar de la experiencia adquirida en este campo, el índice total de órganos trasplantados sigue siendo inferior a los de la ME, y el índice de donantes en DA descartados es superior a los descartados en ME.

La Primera Conferencia Internacional sobre Donación en Asistolia se celebró en Maastrich en 1995, e identificaba cuatro categorías de donantes en asistolia dependiendo del contexto en el que se producía la parada cardiorrespiratoria. Y aunque esta clasificación es la que se utiliza en el ámbito internacional, no capta la realidad de nuestro país en cuanto al tipo de DA que se lleva a cabo. La experiencia ha demostrado la necesidad de diferenciar entre la parada cardiorrespiratoria (PCR) que se produce en el medio extrahospitalrio, de la que se produce en el medio hospitalario.
Surge entonces la clasificación de Maastrich modificada (Madrid 2011), que recoge dos grandes grupos:
Donación en asistolia no controlada (DA no controlada):
Tipo I. Fallecidos fuera del hospital que no son resucitados por diversas razones.
Tipo II. Resucitación infructuosa: pacientes que sufren una PCR y en los que las maniobras de reanimación no tienen el resultado esperado. Además, aquí podemos diferenciar dos subgrupos:
II a. Extrahospitalaria: la PCR ocurre en el ámbito extrahospitalrio, atendida por los servicios de emergencias, y el paciente es trasladado al hospital con compresiones torácicas mecánicas y soporte ventilatorio.
II b. Intrahospitalaria: la PCR es intrahospitalaria, presenciada por personal sanitario, y las maniobras de resucitación se inician inmediatamente.
Donación en asistolia controlada:
Tipo III. A la espera del paro cardiaco en aquellos pacientes en los que se ha decidido instaurar limitación del tratamiento de soporte vital (LTSV).
Tipo IV. Paro cardiaco en muerte encefálica. La PCR ocurre mientras se establece el diagnóstico de muerte encefálica, o después del diagnóstico de ME, pero antes de ser llevado al quirófano para la extracción de los órganos. Si no se restablece la función cardiada, se orienta hacia la donación en asistolia.
Como hemos visto, nuestra Legislación regula, en el Real Decreto 1723/2012 de 28 de diciembre, las actividades para la obtención y utilización de órganos humanos, y la coordinación territorial en materia de donación y trasplante de órganos y tejidos. Así mismo recoge que el fallecimiento de una persona puede diagnosticarse con la confirmación del cese irreversible de las funciones cardiacas y respiratorias (muerte por PCR), o de las funciones encefálicas (ME).
En el mismo Real Decreto, el artículo 9 establece que la obtención de órganos de fallecidos solo podrá hacerse previo diagnóstico y certificación de la muerte (según lo establecido en el mismo RD), las exigencias éticas, los avances científicos en la materia, y la práctica médica aceptada.
El cese cardiaco y respiratorio se reconocerá mediante un examen clínico, además de un periodo de observación determinado. La hora del fallecimiento será la hora en la que se diagnosticó el cese de la actividad cardiorrespiratoria, y debe realizarse por tres médicos que no pueden formar parte del equipo extractor o implantador de los órganos.
El grupo de pacientes que se incluyen en el grupo de DA controlada son aquellos que sufren una lesión cerebral irreversible, pero que no cumplen los criterios de muerte encefálica, y todos aquellos pacientes con enfermedades pulmonares y musculoesqueléticas en fase terminal, lesiones espinales graves, o aquellos pacientes en los que la reanimación cardiopulmonar ha sido infructuosa y se determina un daño neurológico desastroso.
1. LIMITACIÓN DEL TRATAMIENTO DE SOPORTE VITAL (LTSV) ORIENTADO A LA DONACIÓN EN ASISTOLIA CONTROLADA
La donación en asistolia es una técnica relativamente nueva en nuestro país, y a pesar de los avances en los conocimientos sobre la materia, y en la adquisición de experiencia, el índice de órganos obtenidos en donación en asistolia sigue siendo inferior al de los obtenidos en ME, ya que la donación en asitolia está muy limitada por el tiempo de isquemia caliente, que puede dañar los órganos y hacerlos inviables, sobre todo en aquellos casos en los que la PCR se produce de forma imprevista y no se conoce el tiempo exacto de isquemia caliente.
Aunque la limitación del soporte vital lo hemos visto ampliamente en el Tema 3, es importante hacer algunos apuntes, y mostrar la diferencia que existe entre orientar la LTSV hacia la donación en muerte encefálica o hacia la donación en asistolia.
La decisión de LTSV es independiente de la posibilidad de la donación de órganos, y se realiza en las Unidades de Críticos en aquellos hospitales que dispongan de un protocolo de LTSV, consensuado entre los profesionales y los Comités de Ética. La actuación en la LTSV debe basarse en las Recomendaciones de Tratamiento al final de la vida del paciente crítico, desarrolladas por el Grupo de Bioética de la SEMICYUC.
Antes de solicitar la donación de órganos, tras la LTSV, el coordinador de trasplantes y el médico responsable del paciente, realizarán las pruebas necesarias para asegurar que no existen contraindicaciones absolutas para la donación.
Cuando se plantea a la familia la decisión de LTSV, es importante hacerles entender la situación real del paciente. Es una situación difícil de aceptar, y la familia necesita tiempo para asimilar la información y exponer sus dudas. Una vez han aceptado y han comprendido la situación, y dejando pasar el tiempo necesario para que superen el primer momento de dolor, será el coordinador de trasplantes quien planteará la posibilidad de la donación en asistolia de órganos y tejidos.
Durante la entrevista es importante dejar claro a la familia que su negativa para la donación es igualmente aceptable, y que no influirá en los cuidados y la atención que se aplicarán tanto al paciente como a la familia, hasta que acontezca la muerte.
Si la familia acepta la donación, es fundamental explicar el procedimiento completo:
Lugar donde se retirará el soporte vital. La retirada de las técnicas de soporte vital (ventilación mecánica, extubación, drogas vasoactivas, etc.) se realiza después de que la familia haya firmado el consentimiento para la donación. El lugar más adecuado para la desconexión de la ventilación mecánica es la Unidad de Cuidados Intensivos en la que se encuentre el paciente, aunque dependerá de cada centro, de las posibilidades para atender al paciente y a sus familiares, y del método de preservación y extracción empleados. Si se realiza en el quirófano, la extubación dependerá exclusivamente del equipo asistencial de la UCI donde estaba ingresado el paciente. El quirófano debe contar con toda la infraestrucutra preparada para la extracción de órganos y tejidos, y así minimizar los tiempos de isquemia.
Tanto si se realiza en el quirófano como en la Unidad de Críticos, se debe ofrecer a la familia la posibilidad de acompañar al paciente hasta el último momento. Su decisión, en un sentido o en otro, siempre debe ser respetada.
Una vez extubado el paciente y hasta la aparición de la asistolia, tanto en el quirófano como en la UCI, deben registrarse los periodos de hipotensión, hipoxia o anuria, monitorizando:
- Presión arterial invasiva: sistólica, diastólica y media.
- Frecuencia y ritmo cardiaco.
- Pulsioximetria.
- Diuresis inicial (extubación) y final (PCR)
Intervenciones pre-mortem. En la DAC es necesario realizar algunas intervenciones previas a la muerte del paciente dirigidas a optimizar el proceso de la donación, facilitando la perfusión y preservación de los órganos y tejidos. Generalmente son: administración de 500-1000 UI/Kg de heparina sódica EV antes de la retirada del soporte vital, o entre la extubación terminal y la asistolia, y administración de hemoderivados y otros fármacos. Es necesario que la familia entienda que la administración de fármacos está destinada a mejorar la función del órgano tras el trasplante, y no a acelerar la muerte del potencial donante.
A veces es necesaria la canulación (arteria y venas femorales), y la perfusión in situ de líquido de preservación, previas a la extubación. En este caso, además del consentimiento para la donación es necesario solicitar el documento de Consentimiento Informado a la familia para la realización de estas técnicas. Se debe informar también a la familia de la posibilidad de que tras la retirada del SV no se produzca la asistolia, por lo que el paciente continuará en la UCI con los cuidados al final de la vida adecuados. Siempre se mantendrá la sedación y analgesia a las dosis necesarias para garantizar el confort, y evitar el sufrimiento del paciente.
Una vez retirado el soporte vital, debe ser un intensivista, ajeno al proceso de la donación, quien confirme la muerte después de observar durante 5 minutos: ausencia de curva en la monitorización invasiva arterial, apnea y ausencia de respuesta a estímulos.
Si transcurridas dos horas no se produce la asitolia, el paciente regresa o permanece en la UCI, donde se continúan los cuidados al final de la vida.
2. DIAGNÓSTICO DE MUERTE POR CRITERIOS CIRCULATORIOS Y RESPIRATORIOS
El diagnóstico de muerte por criterios circulatorios y respiratorios, es decir en asistolia, se basa en el cese irreversible de la circulación sanguínea y ausencia de respiración espontánea.
El concepto de irreversibilidad varía según hablemos de DAC o DA no controlada. En esta última, se considera irreversible cuando después de realizar las maniobras de RCP según los protocolos establecidos por las sociedades científicas competentes, ha sido imposible restaurar la respiración y la circulación, tras un periodo de observación no inferior a 5 minutos. Y al referirnos a la DAC, la determinación de irreversible se certifica tras el periodo de observación (5 minutos) durante el cual hay un cese de la función cardiorrespiratoria, sin maniobras de RCP.
Para certificar la muerte por criterios cardiorrespiratorios se debe verificar que:
- Se han realizado maniobras de resucitación avanzada (SVA), que han sido infructuosas y que se han realizado por un tiempo adecuado, que dependerá de la edad del paciente y de las circunstancias que provocaron la parada cardiorrespiratoria, siguiendo los protocolos establecidos por las sociedades científicas pertinentes. En casos de hipotermia inferior a 32º C, se debe calentar al paciente antes de certificar el cese irreversible de las funciones cardiaca y respiratoria.
- O bien que no está indicada la resucitación cardiopulmonar según criterios médicos, y según las recomendaciones de las sociedades científicas competentes.
La ausencia de circulación sanguínea debe quedar demostrada por al menos uno de los siguientes hallazgos, o por cualquier otra prueba instrumental que acredite garantía diagnóstica para ello:
- Asistolia en un electrocardiograma continuo.
- Ausencia de flujo sanguíneo en la monitorización invasiva de la presión arterial (catéter arterial).
- Ausencia de flujo aórtico en un ecocardiograma.
Las alteraciones que se producen durante el tiempo de isquemia caliente inducen al rápido deterioro celular, estructural y funcional, así como a una situación de inflamación celular que deriva en la muerte de la célula por rotura de su membrana y necrosis. Por regla general, las guías de práctica clínica y el consenso de expertos, se acepta que el tiempo transcurrido desde la retirada del soporte vital hasta la asistolia sea de 30 a 90 minutos, en función del órgano a trasplantar.
Si no se produce la asistolia en este periodo de tiempo, se pondrá fin al proceso de donación y se continuarán con los cuidados de confort al final de la vida.
Para no crear falsas esperanzas a familiares y allegados, y como herramienta predictora para el coordinador de trasplantes, existen scores de probabilidad de asistolia: “Criterios UNOS”, “Escala de la Universidad de Wisconsin”, “Escala de United Network for Organ Sharing”, ”DCD-N score”, (por citar algunos ejemplos), que hacen predicción del tiempo en el que aparecerá la asistolia, asigando una puntuación a diversos ítems, como la presencia o no de drogas vasoactivas, datos antropométricos del paciente, la edad, la presencia o no de intubación orotraqueal, presencia o no de respiración espontánea después de 10 minutos de la retirada de la ventilación mecánica, y/o saturación de oxígeno, etc., aunque ninguna de ellas tiene mucho valor predictivo en la práctica clínica, ya que dependen de las características de cada paciente, y en ocasiones precisan la realización del test de apnea, lo que produce aún más complicaciones en el paciente.
3. DETECCIÓN Y EVALUACIÓN DEL POTENCIAL DONANTE EN ASISTOLIA. CRITERIOS DE EXCLUSIÓN
Cuando se habla del proceso de DA, es importante diferenciar la DA controlada (DAC) y la DA no controlada, ya que ambos procesos se diferencian en varios aspectos, como son la forma en la que se detecta al potencial donante, los tiempos de isquemia, la posibilidad de administrar premortem sustancias preservadoras que mejoran la viabilidad del injerto, las técnicas de canulación y extracción, el proceso para obtener la autorización para iniciar el proceso de donación, y en el caso de la DA no controlada, es necesaria la participación y coordinación de los profesionales de la atención extrahospitalaria.
Se considera posible donante en asistolia controlada al paciente con daño cerebral grave que no deriva en ME, o con fallo circulatorio y respiratorio, y sin contraindicaciones médicas para la donación de órganos.
La detección del donante en DAC comienza cuando el equipo asistencial decide adecuar o retirar el soporte vital por considerlo fútil, como hemos visto anteriormente, o en aquellos casos en los que el paciente con daño cerebral catastrófico no va a terminar en muerte encefálica, y la familia está dispuesta a realizar la donación, pero decide no prolongar la espera. En este momento el objetivo terapéutico cambia de ser curativo a la aplicación de medidas de confort, tanto del paciente como de sus familiares.
En el caso de la DA no controlada, la detección y evaluación de potencial donante se realiza in situ, y su mantenimiento y traslado al hospital son, posiblemente, las principales limitaciones en este tipo de donación, ya que precisan de un servicio de emergencias bien dotado y entrenado en maniobras de preservación de órganos, y contar con el apoyo de servicios ajenos al hospital, como las Fuerzas y Cuerpos de Seguridad, imprescindibles para el traslado del fallecido al hospital y localizar a sus familiares.
La evaluación del posible donante en DAC no difiere de la evaluación del donante en ME, y se realiza siguiendo las pautas que hemos visto en el Tema 2, como son la revisión minuciosa de su historia clínica, la realización de pruebas complementarias (análisis de sangre, determinación del grupo sanguíneo, cribado serológico, estudio de histocompatibilidad, estudio microbiológico y marcadores tumorales), pruebas de imagen, etc.
Por tanto, es un potencial donante en asitolia controlada aquel paciente sin evidencias de contraindicaciones absolutas: tumores, infección no controlada o disfunción multiorgánica, en los que se ha decidido aplicar medidas de LTSV, y en los que se espera se produzca una parada cardiorrespiratoria en las horas siguientes a la retirada de las medidas de soporte.
Las patologías y situaciones que pueden derivar en una donación en asistolia controlada son:
- Pacientes con patología neurológica grave, con pronóstico funcional catastrófico en los que no es previsible la evolución a muerte encefálica. Se incluyen pacientes en coma o en estado vegetativo por lesiones cerebrales de causa isquémica, hemorrágica o traumática, lesiones medulares altas o enfermedades neuromusculares altas.
- Pacientes con patologías respiratorias o cardiológicas, con evolución o pronóstico desfavorable, en las que las medidas terapéuticas han sido ineficaces.
Las contraindicaciones para la donación, tanto absolutas como relativas, son comunes a cualquier tipo de donación, ya sea en muerte encefálica o en donación en asistolia. Aunque la mayoría de los programas son más restrictivos en cuanto a la donación en asistolia, sobre todo para la DA no controlada.
Así, la ONT recomienda para la donación en asistolia no controlada:
- Edad del donante entre 1 y 55 años, (65 años para la DAC), revisable según estudios de viabilidad para la donación de órganos y tejidos.
- Es aceptable cualquier tipo de parada cardiorrespiratoria, sin excluir las producidas por agresión.
- Se descartan aquellos donantes que presentan lesiones torácicas o abdominales que comporten sangrado masivo (aunque las lesiones abdominales pueden no contraindicar la extracción pulmonar), y los que tengan marcas o indicios de adicción a drogas parenterales.
- Ausencia de infecciones sistémicas o enfermedades neoplásicas que suponen una contraindicación para la donación.
- Además, se descartará al posible donante si el tiempo transcurrido desde la parada cardiorrespiratoria hasta el inicio del soporte vital avanzado (tiempo de parada) supera los 15 minutos, o si el tiempo transcurrido desde la parada cardiorrespiratoria hasta la llegada al hospital supera las dos horas.
Es de suma importancia en el caso de la DAC el tiempo en el que se producirá la muerte, una vez retiradas las medidas de soporte vital o tiempo de isquemia caliente, que es el factor más importante para determinar la viabilidad del órgano a trasplantar, aunque este periodo depende de las condiciones hemodinámicas o respiratorias del paciente, es decir, del tiempo que permanece en hipoperfusión.
Tiempos en el proceso de donación en asistolia controlada.
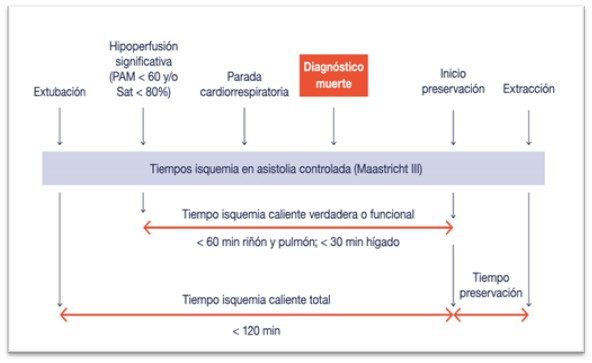
Fuente: Donación-asistolia-Maastricht-III-Ocronos-Editorial científico-técnica.
4. ACTIVACIÓN DEL CÓDIGO DE DONANTE EN ASISTOLIA NO CONTROLADA
Una vez identificado un potencial donante en asistolia no controlada, y con una valoración positiva para la donación, en España se utiliza una secuencia común para la activación y puesta en marcha de toda la logística, tanto intrahospitalaria como extrahospitalaria, necesaria para optimizar y preservar los órganos para la donación.
Operativo extrahospitalario:
- Alertar al centro hospitalario de referencia y al coordinador de trasplantes de que se está realizando un intento de reanimación.
- Constatación de los criterios de inclusión in situ del potencial donante en asistolia y primera comprobación del tiempo en asistolia y de RCP.
- Intubación orotraqueal in situ, con tubo endotraqueal de gran calibre, y ventilación mecánica con FiO2 de 1 y frecuencia ventilatoria de 15 rpm.
- El traslado se realiza con cardiocompresión automática continua.
- Colocación de acceso venoso para fluidoterapia, evitando la sobrehidratación y la administración de fármacos.
- La ambulancia debe ir a velocidad constante, evitando aceleraciones y desaceleraciones.
- Información para el personal del hospital:
- Filiación personal del fallecido: nombre y apellidos, edad, sexo, antecedentes personales (si se conocen), datos de familiares y el contacto, y causa de la PCR.
- Hora exacta de la PCR, hora de inicio de las maniobras de RCP y hora de transferencia al hospital.
- Posibles lesiones hemorrágicas, accesos venosos canulados, estado del tubo endotraqueal (presencia de sangre, moco, otros restos). Gasometría arterial. Test de drogas, y si se dispone de ellas, tira reactiva de VIH y ECOFAST (ecografía centrada en 4 puntos para determinar hemoperitoneo, hemopericardio o hemo/neumotórax).
Recursos humanos, materiales y logística:
- Ambulancias con SVA y/o helicópteros medicalizados.
- Coordinación con otros servicios: bomberos, cuerpos de seguridad, etc.
- Conexión telefónica directa con el coordinador de trasplantes, que debe aceptar el traslado del potencial donante y activar el Código de Donación en Asistolia.
- Aviso a los servicios de urgencias y medicina intensiva del hospital receptor de la inminente llegada del potencial donante.
- La llegada al hospital debe ser antes de 120 minutos desde la PCR.
- El servicio de emergencias debe contar con un protocolo de DA, y el hospital con un programa de trasplantes.
- A la llegada al hospital de destino, se canulan catéteres de doble balón para iniciar, de forma rápida, la perfusión con máquinas de circulación extracorpórea.
Una vez que el coordinador de trasplantes recibe el aviso de un posible DA no controlada se debe personar en el centro, activar a los equipos de extracción, y a todo el personal necesario e implicado en el proceso (cirujanos, enfermeras, patólogos, microbiólogos, etc.). El coordiandor reevalúa al donante para seguir o no, con el proceso de donación, según los criterios generales de selección de donantes, y los específicos para el donante en asitolia (tiempos de isquemia), antes de realizar la entrevista con la familia y pedir la solicitud de donación. El intensivista o el médico de urgencias, ajenos al proceso de donación, deben certificar la muerte por criterios cardiorrespiratorios.
Los casos de muerte violenta o sospechosa de acto criminal, o en aquellos casos en los que el médico que certifica la muerte tiene dudas en cuanto a la causa de la muerte, entrarían en un proceso judicial. En este caso, se envía una solicitud al Juzgado de Guardia para iniciar las maniobras de preservación del cadáver, aunque en el RD 2070/1999 señala que, si transcurridos 15 minutos desde la solicitud al Juzgado no existe respuesta, podrán iniciarse las maniobras de preservación por considerarse autorizadas. Tras el consentimiento de la familia para la donación, se establece una segunda comunicación con el Juzgado para entregar: consentimiento de la familia para la donación, datos de la historia clínica que hubieran podido afectar a las circunstancias de la muerte, copia del informe de urgencias, solicitud de los órganos y tejidos a extraer, tanto para la donación como para investigación clínica.
Se obienten entonces muestras de sangre, grupo sanguíneo, serologías y tejido linfático (ganglio) lo antes posible, para realizar el tipaje HLA, y se administra al potencial donante un bolo de heparina de 500 UI/Kg de peso.
Deben extraerse también una muestra de 20 cc de sangre, 20 cc de orina y 20 cc de jugos gástricos, que quedarán a disposición del Juzgado de Instrucción (siguiendo el protocolo de cadena de custodia establecido), así como cualquier otra muestra o dato que requieran.
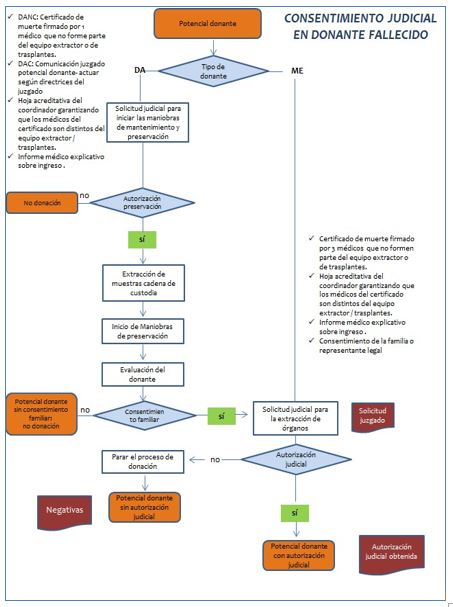
Fuente: Proceso de consentimiento a la donación de fallecido. ONT
La comunicación y localización de la familia se hace a través de la policía, o por datos internos del hospital. El tiempo límite para localizarlos y obtener su autorización para la donación es de 4 horas.
Posteriormente, se traslada al paciente a la UCI o al quirófano para iniciar las maniobras de preservación, que deben estar instauradas en menos de 120 minutos desde que se produjo la PCR.
Una vez obtenida la autoriación se extraen los órganos, riñones, hígado y pulmones, así como los tejidos, y se procede a su preservación y registro de órganos según los protocolos establecidos (Tema 3). El proceso termina con la comunicación al Juzgado del final de la extracción.
Tiempos en el proceso de donación en asistolia no controlada.
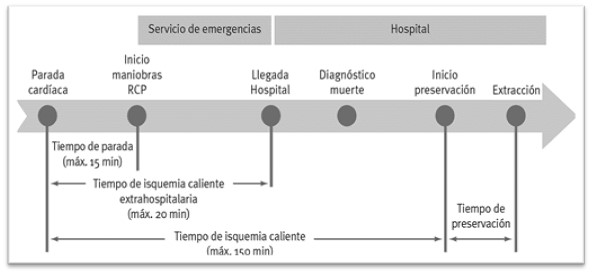
Fuente: Revista de formación para Técnicos en Emergencias Sanitarias- ZONA TES.
4.1. Entrevista con la familia en el donante en asistolia no controlada.
Hemos visto en temas anteriores que la entrevista con la familia en el proceso de donación es uno de los momentos más delicados de todo el proceso, por las condiciones que rodean a la muerte de un ser querido. En el caso de la donación en asitolia no controlada, el coordinador de trasplantes debe cuidar aún más la forma en la que se realiza la entrevista con la familia, dadas las especiales características que se reúnen en este tipo de donantes. Por un lado, se trata de muertes súbitas o inesperadas, con toda la carga emocional que esto supone para la familia; y por otro lado, el tiempo del que se dispone para comunicar el fallecimiento y solicitar la donación es muy escaso.
Para ello, se sigue el siguiente protocolo:
- Una vez localizados a los familiares por la policía, son acompañados hasta el hospital.
- A su llegada son recibidos por personal del hospital que los acompaña a una sala privada, a ser posible con teléfono para comunicaciones con familiares, permaneciendo con ellos para intentar atenuar la sensación de soledad y desamparo.
- Es el intensivista quien comunica a la familia la muerte del paciente. Y una vez que han aceptado la situación, y transcurrido un tiempo prudencial para manejar su dolor, es cuando el coordinador de trasplantes les plantea la posibilidad de la donación.
- El abordaje de la entrevista es diferente por dos factores determinantes: primero por lo inesperado de la muerte, y segundo por la imposibilidad de que toda la familia esté presente en la información y la toma de decisiones.
Si bien la entrevista familiar está definida dentro de un esquema general de solicitud de órganos, en este caso se introducen algunas variaciones. Por ejemplo, es necesario dar más tiempo que en el caso de ME o DA controlada desde la comunicación de la muerte hasta la solicitud de la donación. La comunicación del fallecimiento provoca mayor explosión de sentimientos, secundarios siempre a lo inesperado del fallecimiento. En el caso de ME, ha habido oportunidad de ir preparando a la familia para el fatal desenlace mientras el paciente permanece ingresado en la UCI.
Y sin embargo, la muerte por criterios cardiorrespiratorios es un concepto más asequible para la mayor parte de las personas que el concepto de muerte encefálica, cuando permanecen junto al potencial donante, y éste sigue monitorizado y conectado a ventilación mecánica. Es importante decir que la donación en asistolia plantea menos negativas familiares que la donación en muerte encefálica.
5. PRESERVACIÓN Y EXTRACCIÓN DE ÓRGANOS
Una vez retirado el soporte vital, es imprescindible controlar en tiempo del periodo agónico, el tiempo de isquemia caliente total, y el inicio precoz de las maniobras de preservación de órganos.
- Tiempo de isquemia caliente total: tiempo que transcurre desde la retirada del soporte vital hasta el inicio de las maniobras de preservación de los órganos.
- Tiempo de isquemia caliente verdadera o funcional: tiempo que transcurre desde una hipoperfusión significativa y mantenida (saturación de oxígeno en pulsioximetría < 80% y/o TA sistólica < 60 mmHg), contando desde el primer episodio de estas características, hasta el inicio de las maniobras de preservación.
- Don’t touch period o periodo de observación: tiempo que transcurre desde la parada cardiorrespiratoria hasta la certificación de la muerte. Es el tiempo mínimo para descartar fenómenos de auto-resucitación, y aunque varía según la legislación de cada país (entre 2 y 20 minutos), en España se ha establecido un tiempo mínimo de 5 minutos.
- Tiempo de preservación: tiempo que transcurre desde el inicio de las maniobras de preservación (perfusión in situ o circulación extracorpórea) hasta el inicio de la extracción de órganos.
- Tiempo de isquemia fría: tiempo que transcurre desde el inicio de la perfusión de solución fría hasta la cirugía del trasplante.
Una vez obtenida la autorización, y certificada la muerte del paciente, después de 5 minutos de observación en los que no debe haber curva en la monitorización arterial, ni respiración espontánea, ni respuesta a estímulos dolorosos, y la asitolia está demostrada por el cese de las contracciones cardiacas en una ecocardiografía, y la ausencia de actividad eléctrica queda reflejada en el monitor, comienza el procedimiento de preservación de los órganos, de forma precoz, para reducir al máximo el tiempo de isquemia caliente.
Las maniobras de preservación de los órganos se realizarán o bien en la propia Unidad de Críticos o en el quirófano, según las características y necesidades de cada hospital, y las llevan a cabo el equipo quirúrgico de trasplantes, con el apoyo y supervisión del coordinador de trasplantes.
En el caso de la donación en asistolia, las técnicas de preservación se diferencian según sean los órganos de elección, es decir, si van destinadas a la preservación de órganos abdominales, o a la preservación pulmonar.
Preservación de órganos abdominales. Se dividen en dos grandes grupos, atendiendo al objetivo terapéutico que se quiere obtener:
- Técnicas de enfriamiento rápido, encaminadas a reducir el metabolismo celular y preservar los órganos del efecto perjudicial de la isquemia caliente: perfusión in situ y recirculación hipotérmica.
- Técnicas de restablecimiento de la perfusión de los órganos con sangre normotérmica oxigenda, destinadas a recuperar el metabolismo celular y su carga energética, recuperando así la lesión isquémica: recirculación nomotérmica o NECMO.
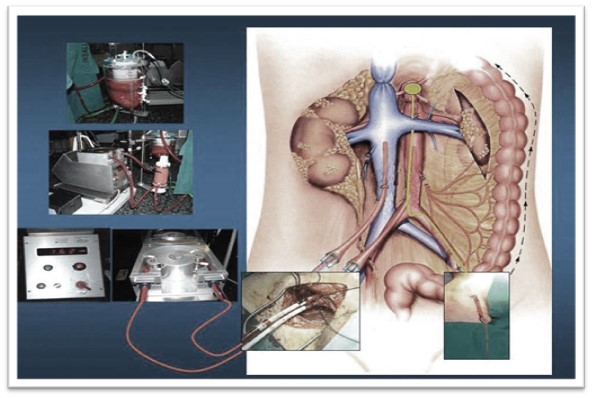
Perfusión in situ (exclusivamente para extracción renal): Serán necesarias la canulación de arteria y vena femorales, premortem o postmortem. Se realiza el drenaje del contenido hemático, y se perfunde el líquido de preservación. Puede ser necesario administrar vasodilatadores, anticoagulantes o fibrinolíticos. El donante se mantiene con compresión torácica constante y ventilación mecánica hasta su traslado a quirófano, donde se realiza la extracción super-rápida de los órganos, y la perfusión fría con las soluciones de preservación.
Perfusión in situ
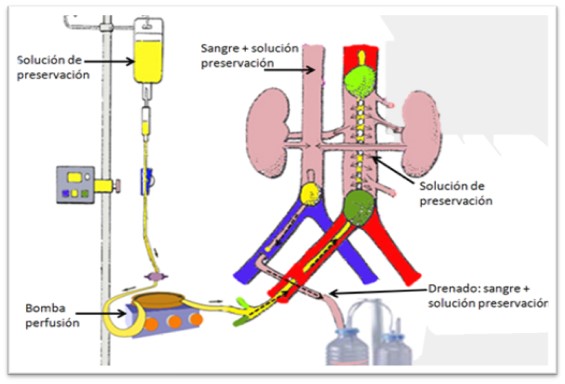
Fuente: Donación y trasplantes de órganos y tejidos.
Recirculación hipotérmica (exclusivamente para extracción renal): se utiliza la circulación extracorpórea ECMO, con canulación premortem de los vasos femorales, y oclusión con balón de la aorta torácica para asegurar la recirculación selectiva de los órganos abdominales. La sangre se oxigena y se enfría a 15º C, lo que permite un enfriamiento más suave y progresivo de los órganos, proporcionando una mejor perfusión distal y una oxigenación continua de los órganos en la fase de hipotermia.
Recirculación normotérmica regional (PRN) o membrana de oxigenación (NECMO). Consigue mejor funcionalidad del órgano y menor número de complicaciones post-trasplante. Es la técnica de elección para la preservación de órganos abdominales en DA, sobre todo en DA no controlada. La técnica es similar a la recirculación hipotérmica, pero la sangre se mantiene a 37º C hasta la perfusión fría con la solución de preservación en el quirófano. Se debe re-heparinizar cada 90 minutos con 250 UI/Kg de heparina sódica, y se prolonga hasta la visualización de los órganos en el quirófano y la posterior perfusión fría con la solución de preservación. El tiempo mínimo de NECMO es de 30-60 minutos y el máximo es de 4 horas hasta la extracción de los órganos.
Fuente: Donación tras la muerte cardíaca. Parada cardíaca en el mantenimiento del donante en muerte encefálica. Rev. Medicina Intensiva
Preservación de órganos torácicos: pulmón. Se realizan paralelamente a las técnicas de preservación abdominal. El pulmónes el único órgano que no requiere circulación para mantener su metabolismo aerobio, debido al mecanismo de difusión pasiva a través de la membrana alveolar. Se ha demostrado que existe intercambio gaseoso tras 2 horas de isquemia caliente en ausencia de circulación pulmonar.
Después de la retirada de la ventilación mecánica, y después del inicio de la preservación de los órganos abdominales, se insertan drenajes torácicos bilaterales por los que se infunde la solución de preservación a 4º C, hasta conseguir el colapso de los pulmones.
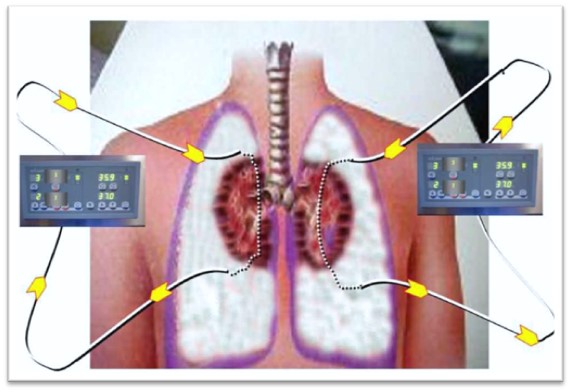
Fuente: Donación tras la muerte cardiaca. Rev. Medicina Intensiva
Perfusión pulmonar ex vivo
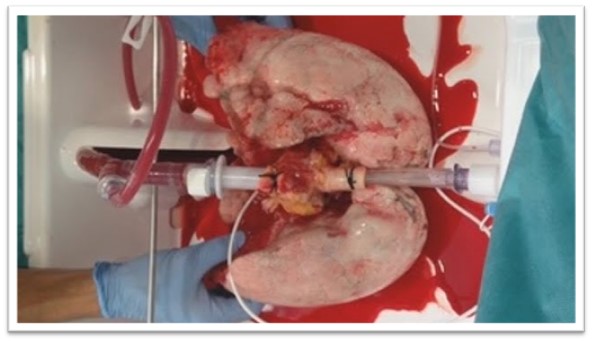
Fuente: “Ex vivo”. La máquina que da un respiro al trasplante pulmonar. Visto en youtube
Las maniobras de preservación se suspenderán en las siguientes situaciones:
- Cuando una vez obtenidos todos los permisos se realice la extracción de órganos.
- Cuando no se obtengan el necesario consentimiento familiar y permiso judicial.
- Pasadas 4 horas de by-pass sin haber completado los requisitos necesarios para iniciar la extracción.
En el momento de la extracción de órganos, el donante a corazón parado suele encontrarse hemodinámicamente inestable, por lo que es necesario realizar técnicas de extracción rápidas, sin apenas disección de los órganos a extraer, siendo prioritario salvar el máximo número de órganos. Si el donante se encuentra hemodinámicamente estable, sería posible la disección, canulación, perfusión y extracción reglada de los órganos.
Los órganos se extraerán después del consentimiento familiar y autorización judicial si procede. Durante el periodo de preservación se contacta con las oficinas de intercambio de órganos (ONT-OCATT) para informar de la existencia de un potencial donante y así poder realizar la adjudicación de los órganos según los criterios de distribución establecidos. El tiempo de respuesta de los equipos extractores debe reducirse al mínimo.
Técnica de extracción super-rápida. Es la técnica de extracción más utilizada en algunos centros, y debe ser realizada por cirujanos experimentados.En esta técnica, la única intervención previa a la certificación de la muerte que se hace sobre el donante es la administración de heparina, previa a la extubación, para preservar la perfusión de los órganos. Se realiza después una canulación post-mortem que permite la extracción de órganos abdominales y torácicos (pulmón) de manera simultánea, con excelentes resultados en la función y superviviencia de los injertos.
- Extracción abdominal: Una vez declarado el fallecimiento, se realiza inmediatamente una laparotomía media con canulación aórtica infrarrenal, para introducir la solución fría de preservación y heparinizar. Luego se clampa la aorta supracelíaca, y se realiza el drenaje por la vena cava inferior, para poder delimitar el territorio de perfusión. Paralelamente, se enfrían de forma externa los órganos abdominales con suero helado o hielo, y se realiza la perfusión a través de la porta, también con suero helado y heparina. Los órganos se pueden extraer en bloque o por separado. Con esta técnica, la perfusión fría puede iniciarse en menos de 3 minutos desde la certificación del fallecimiento.
- Extracción torácica: tras la declaración del fallecimiento, se realiza una esternotomía media y se reintuba al paciente iniciando medidas de reclutamiento manual. Se abre el pericardio hasta el arco aórtico y la arteria pulmonar, se canula el tronco común y se sujeta una cánula manualmente. Se calampa la aorta descendente y se inicia la perfusión del líquido de preservación. Después se drena la aurícula izquierda y se secciona la cava inferior a nivel de la desembocadura de la aurícula derecha. El resto del procedimiento es similar al de una extracción en muerte encefálica, con extracción en bloque de ambos pulmones y corazón.
Una vez se han extraído los órganos, el siguiente pasoes realizar la cirguía de banco parcial o completa y su conservación, con la técnica clásica de la preservación estática fría, como los órganos procedentes de la extracción en muerte encefálica, con el fin de dejarlos preparados para el trasplante.El empaquetado de los órganos se realiza con la misma técnica de la doble bolsa y contenedor rígido, y cada órgano irá acompañado de muestras de tejido: ganglio, bazo y sangre, según lo que indique el equipo de trasplante, acompañado de la documentación necesaria: procedencia y destino del órgano, día y hora de salida del centro de obtención, recomendaciones de transporte, informe sobre las características del donante y del órgano, su extracción y las soluciones de preservación utilizadas, y los estudios realizados y sus resultados.

Finalmente, la reconstrucción del cadáver debe ser muy cuidadosa y se hará con el máximo respeto, y es fundamental mantener la dignidad del cadáver y el aspecto externo antes de ser entregado a la familia.
BIBLIOGRAFÍA
- Abradelo de Usera M, Muela A, Aldabó Pallás T, et al. Donación en asistolia en España: Situación actual y recomendaciones. Documento de consenso nacional 2012 [Internet] 2012. Disponible en: http//www.ont.es.
- Actividad de donación y trasplante. España 2019. Memorias ONT [Internet]. Disponible en: http://www.ont.es/infesp/Memorias
- Alonso M, Álvarez Miranda M, Álvarez Vázquez M, et al. El modelo español de coordinación y trasplantes. ONT [Internet]. Madrid: Grupo Aula Médica SL; 2008. Disponible en: http//www.ont.es
- Álvarez Rrodríguez J. Coordinación del equipo de trasplantes. Revistas científicas. [Internet] 1999. Disponible en: http://revistas.ucm.es
- Aristizabal AM, Caicedo LA, Martínez JM, et al. Xenotrasplantes, una realidad cercana a la práctica clínica: revisión de la literatura. Cirugía española [Internet] 2017; 95 (2): 62-72. Disponible en: http://www.elsevier.es.
- Benítez Hernández P. Cuidados de enfermería al paciente donante de órganos y tejidos en muerte encefálica. Revisión bibliográfica [Internet]. Universidad de la Laguna, 2020. Disponible en:https://riull.ull.es/xmlui/bitstream/handle
- Cano Ochando E, Nistal Villan E. Avances y retos en investigación en el trasplante de órganos. Fundación Ramón Areces. Revista-fra [Internet]; (22): 104-117. Disponible en: https://www.fundacionareces.es/recursos/doc/portal/2019/12/27
- Carnevale Romina P. La impresora de órganos. Ficciones y realidades de la producción de tejidos artificiales. Química Viva [Internet]. 2010; 9(2): 76-85 Disponible en: https://www.redalyc.org/articulo.oa
- César Juárez ÁA, Olivos Meza A, Landa Solís C, et al . Uso y aplicación de la tecnología de impresión y bioimpresión 3D en medicina. Rev. Fac. Med. [Internet] 2018; 61 (6): 43-51. Disponible en: http://www.scielo.org.mx/scielo.
- Ciria R, Garrote D, Briceño J, et al. Donación en asistolia. Medicina clínica monográfico [Internet] 2012; 13 (1): 7–11. Disponible en:http//www.elsevier.es
- Consideraciones éticas en el trasplante de donante vivo. Comité de Bioética de Catalunya [Internet] 2012.Disponible en: http://canalsalut.gencat.cat
- Cuidados Intensivos orientados a la donación de órganos. Recomendaciones. Grupo de trabajo SEMICYUC-ONT [Internet] 2017. Disponible en: http//www.ont.es
- De Frutos MA, Daga D, Ruiz P, Requena MV. Donantes de órganos. Visto en: www.sld.cu/galerias/pdf/sitios/pdguanabo/transp.pdf
- d´Empaire G, de d´Empaire ME, Encinoso J. Limitación de medidas terapéuticas en los pacientes críticos. Gac Méd [Internet] 2002; 110 (1): 92-109. Disponible en: http://ve.scielo.org/scielo.php
- Díaz A. Número total de trasplantes de córnea realizados en España 2011-2017. Visto en: es.statista.com
- Documento de Consenso del Grupo deEstudio de la Infección en el Trasplante(GESITRA)pertenecientealaSociedadEspañola de Enfermedades Infecciosas y MicrobiologíaClínica(SEIMC)ylaOrganizaciónNacionaldeTrasplantes(ONT)sobrelosCriteriosdeSelección del DonantedeÓrganosSólidosen relaciónalasEnfermedadesInfecciosas 2019. Disponible en Google.
- Donación cruzada. Programa nacional de donación renal cruzada en España. ONT. Versión 6.0. 2015. Visto en google
- Dueñas Jurado JM. Protocolos clínicos de actuación ante el proceso de donación y extracción de órganos y tejidos para transplante en donación en muerte encefálica. Cuadernos de Medicina Forense [Internet] 2015; 21 (1-2): 34-42. Disponible en: http//scielo.isciii.es
- Elizalde J, Lorente M. Coordinación y donación. Anales Sis San [Internet] 2006; 29 (2): 35-43. Disponible en: http://scielo.isciii.es/scielo.php
- Escudero D. Diagnóstico de muerte encefálica. Med. Intensiva [Internet] 2009; 33 (4): 185-195. Disponible en: http://scielo.isciii.es/scielo.php
- Escudero D, Otero J. Medicina intensiva y donación de órganos. ¿Explorando las últimas fronteras? Med. Intensiva [Internet] 2015; 39 (6): 366-374. Disponible en: http//www.medintensiva.org.
- Eslava Abaurrea ON, Ciganda Cenoz M, Ameztoy Echenique X. Donación en asistolia Maastricht III, concepto, manejo y cuidados de Enfermería en las Unidades de Cuidados Intensivos. Ocronos-editorial científico-técnica. [Internet] 2019. Disponible en: https://revistamedica.com/donacion-en-asistolia-maastricht-iii-cuidados-enfermeria-uci/
- Fleta Asín B., Gonzalvo Liarte MC, Cía Gómez P. Quimerismo: origen e implicaciones médicas. Revista Clínica española [Internet] 2006, 206 (7): 340-342. Disponible en: http://www.revclinesp.es
- González J. Últimos avances en el trasplante de órganos. Avances en salud [Internet] 2020. Health Tech spain.es. Disponible en: https://healthtechspein.es
- Gutiérrez E, Amado A. Selección del donante y criterios de viabilidad de los órganos: expansión de los criterios de donación. Rev Soc Esp Enferm Nefrol [Internet] 2007; 10 (2): 15-25. Disponible en: http://scielo.isciii.es/scielo.php?
- Historia del trasplante. CUCAIBA. Centro único coordinador de ablación e implante de la provincia de Buenos Aires. Ministerio de salud. Disponible en: http://www.cucaiba.gba.gov.ar/?page_id=166
- https://www.lavanguardia.com/historiayvida/mas-historias/20171130/47311455485/8-avances-que-marcaron-la-historia-de-los-trasplantes.html
- López Hernández E, Jaramillo Magaña JJ, Solís H. Alteraciones fisiopatológicas en la muerte encefálica: su importancia para decisiones de manejo y donación de órganos. Gac. Méd. Méx [Internet] 2004; 140 (2): 199-209. Disponible en: http://www.scielo.org.mx/scielo.php?
- Martí Manyalich V. Evolución del procuramiento de órganos en el mundo. Revista médica clínica las Condes [Internet] 2010; 21 (2): 145-151. Disponible en: https://www.elsevier.es
- Miñambres García E, et al. Protocolo Nacional de mantenimiento del potencial donante en muerte encefálica. SEMICYUC-ONT. [Internet] 2020. Disponible en: http://www.ont.es
- Pérez Villares JM. Donación en asistolia. Cuad. med. forense [Internet] 2015; 21(1-2): 43-49. Disponible en: http://scielo.isciii.es/scielo.php
- Plan estratégico en donación y trasplante de órganos. 2018-2022. Sistema español de donación y trasplante. Ministerio de Sanidad, Consumo y Binestar Social y ONT. Visto en Google
- Plan de acción para la mejora de la donación y el trasplante de órganos. “Plan donación cuarenta”. ONT. 2008. Visto en Google.
- Quesada Ballesteros A. Cuidados de enfermería en un potencial donante de órganos. Mantenimiento en UCI. Disponible en: https://www.concursos.formacionalcala.es/ganadores
- Real Padilla MJ, García Fernández JM, Nuño Calderón MC, et al. Donantes con criterios expandidos por edad. Enfermería docente [Internet]2011; 93:4-6. Visto en: http://www.index-f.com/edocente/93pdf/93-004.pdf
- Royo Vergara R. Análisis de la actuación de enfermería en la donación en asistolia controlada tipo III de Maastrich en la Unidad de Cuidados Intensivos. Elaboración de un algoritmo de actuación enfermero. Trabajo de fin de grado de enfermería. 2015-2016. Disponible en:https://academica-e.unavarra.es/xmlui/bitstream/handle
- Sanz J. Cirugía plástica en la antigüedad. Historias de la historia. [Internet] 2019. Disponible en: http://historiasdelahistoria.com
- Solar P, Ovalle R, Simian E, Escobar J, Beca JP. Tres factores que influyen en la actitud de las personas ante la donación de órganos. Rev Chil Cir [Internet]. 2008; 60 (3): 262-267. Disponible en: https://scielo.conicyt.cl/scielo.php
- Ucio P. Introducción a la figura del coordinador de trasplante intrahospitalario dentro del sistema de Salud Pública. Visto en: http://masteralianza.ont.es/download/tesinas_master_2019/Jazmin%20Ovelar.pdf
