1. INTRODUCCIÓN
Una complicación que es relativamente frecuente en los pacientes críticos es la insuficiencia renal aguda (IRA) o fracaso renal agudo (FRA) que se caracteriza por un deterioro de la función renal. La mortalidad en estos pacientes es muy alta, no por causa de la IRA si no porqué son pacientes en estado crítico con sepsis, fallo multiorgánico, shock… El tratamiento de la IRA es una de las cosas que ha evolucionado más en los últimos años en las unidades de críticos. El tratamiento que se utilizaría tradicionalmente en un paciente con IRA es la hemodiálisis intermitente convencional, técnica que producía complicaciones y desequilibrios relacionados con la pérdida excesiva y rápida de electrolitos y líquido, lo que, a su vez, provocaba variaciones del pH, hipotensiones, alteraciones en la concentración de CO2 y O2, etc. Otra técnica de depuración que se podía utilizar era la diálisis peritoneal, que estaba contraindicada en los pacientes que se habían sometido a intervenciones quirúrgicas abdominales o con problemas de infecciones. Ambas técnicas eran mal toleradas por los pacientes críticos, con inestabilidad hemodinámica, además resultaban ineficaces ya que era muy difícil extraer en 4 horas los líquidos que se habían acumulado en 24h. Este desajuste de los líquidos limitaba seriamente un aporte nutricional adecuado, por lo que muchos pacientes estaban mal nutridos, lo que favorecía las infecciones y otras complicaciones.
Con el avance en las técnicas de depuración hay una mejora en el tratamiento de la IRA del paciente crítico ya que las nuevas terapias permiten eliminar agua, electrolitos y otras sustancias de desecho de manera lenta y continua. Así se pueden administrar sueros y aportar las dosis adecuadas de nutrición sin riesgo de sobrecarga de volumen, sin cambios bruscos de electrolitos y con una buena tolerancia hemodinámica.
Desde entonces las técnicas de reemplazo renal han ido evolucionando gracias a los avances técnicos, de manera que se han podido ampliar sus indicaciones, ha mejorado la rentabilidad depurativa y todo ello garantizando una gran seguridad para el paciente. Por eso, debido a esta ampliación y a las diferentes variantes técnicas, es más apropiado denominarlas técnicas continuas de depuración extracorpórea (TCDEC).
2. VENTAJAS DE USAR LAS TCDEC
- La principal ventaja es que aporta mayor estabilidad hemodinámica y así puede utilizarse en pacientes críticos, ya que, al tratarse de un tratamiento lento y continuado, evita cambios bruscos en la volemia del paciente y permite una gran flexibilidad en el manejo hidroelectrolítico y el control metabólico, con un buencontrol de los líquidos. Por esto se considera la técnica de elección para el tratamiento del FRA en pacientes críticos.
- Facilita la administración de nutrición a dosis plenas y medicación endovenosa. Gracias al control de la volemia.
- Hace posible la extracción de líquidos. El balance hídrico negativo beneficia el tratamiento del edema agudo pulmonar y disminuye la presión hidrostática en la circulación pulmonar, mejorando el intercambio gaseoso.
- Permite el aclaramiento de sustancias circulantes como los mediadores de inflamación que intervienen en la evolución del síndrome de distrés respiratorio del adulto (SDRA) y el síndrome de disfunción multiorgánica (SDMO).
3. INCONVENIENTES DE LAS TCDEC
- Existe un mayor tiempo de contacto de la sangre con material extraño, por lo que existe también mayor riesgo de reacción inflamatoria.
- Al ser una terapia larga hay mayor necesidad de anticoagulación.
- Riesgo de infradosificación de antibióticos.
- Reposo relativo del paciente.
4. INDICACIONES
La mayor incidencia de FRA se encuentra en los pacientes ingresados en las UCI. En el 80% de los casos esta insuficiencia renal se trata con TCDEC. Las indicaciones pueden ser renales o no renales.
Indicaciones renales
- Insuficiencia renal aguda que se manifiesta con disminución de la función excretora (diuresis menor de 0.5 ml/kg/h.) o pérdida de capacidad de los
riñones para excretar nitrógeno y otras sustancias de desecho (aumento de la creatinina sérica de al menos 0.5 mg/dl o cifras mayores del 50% sobre el valor basal).
- Insuficiencia renal crónica agudizada.
Hay que tener en cuenta que las TCDEC no curan la IRA, si no que sustituyen la función renal mientras los riñones se recuperan.
Indicaciones no renales
- Hipervolemia, con o sin IRA. Ayuda a eliminar líquido del espacio intersticial.
- Shock séptico. Como ya hemos dicho, el balance negativo, disminuye la presión hidrostática, de manera que favorece el intercambio gaseoso, así mejoran la función pulmonar y hemodinámica del paciente crítico.
- Síndrome de disfunción multiorgánica. Debido al aclaramiento de algunas sustancias como los mediadores de inflamación (citoquinas), favorece una mejoría hemodinámica y respiratoria, y parece ser que también una mejora en su evolución.
- Insuficiencia cardíaca congestiva y cirugía cardíaca. Las TDEC consiguen disminuir el volumen intravascular e intersticial en insufciencia cardíaca congestiva resistente al tratamiento convencional. Además de conseguir una mejoría hemodinámica durante el postoperatorio.
- Fallo hepático. Puede ser de utilidad para el control de líquidos durante y en el postoperatorio del trasplante hepático manteniendo la estabilidad hemodinámica del paciente.
- Intoxicaciones. La eliminación lenta pero continua de algunas drogas, evita el posible efecto rebote que a veces ocurre con la hemodiálisis convencional en el tratamiento de intoxicaciones.
- Acidosis láctica. Permite la administración de grandes cantidades de bicarbonato sin el riesgo de hipernatremia ni de hipervolemia.
- Alteraciones electrolíticas. Las TDEC normalizan las concentraciones electrolíticas con la utilización de líquidos de diálisis y de reposición adecuados a las necesidades del paciente.
- Hiper/hipotermia. El circuito extracorpóreo permite regular la temperatura de la sangre del paciente, para así corregir una hipotermia o una hipertermia que no responde a los tratamientos convencionales.
- Rabdomiolisis y Síndrome de aplastamiento. La liberación de mioglobina que se produce en la rabdomiolisis y el síndrome de aplastamiento, puede producir un fallo renal que se puede corregir con las TCDEC ya que la mioglobina se puede
- eliminar a través de las membranas de los circuitos.
- Grandes quemados. Se pueden utilizar las TCDEC para un mayor control de los líquidos y del estado catabólico del paciente.
5. PRINCIPIOS BÁSICOS DE LAS TCDEC
Las TCDEC consisten en el contacto indirecto entre la sangre y el líquido de diálisis a través de una membrana semipermeable que permite el paso de sustancias de un compartimento al otro (sanguíneo y dializador). En todas las TCDEC los solutos se extraen de la sangre para que pasen al compartimIento del ultrafiltrado del dializador.
Para que la terapia funcione, enfermería tiene un papel fundamental, ya que es la responsable del inicio, mantenimiento y fin de la terapia. Y además es la responsable del control hemodinámico e hídrico del paciente.
La función de la membrana depende del tamaño de sus poros y, del peso molecular de los solutos. El peso molecuar del soluto depende de 2 factores:
- Velocidad: la velocidad de una molécula es inversamente proporcional a su peso molecular. Es decir, como más bajo sea el peso de la molécula, más se mueve y por lo tanto más veces choca contra la membrana. En cambio, las moléculas más grandes, se mueven menos y chocan con menos frecuencia contra la membrana semipermeable y se hace más complicado que traspasen la membrana.
- Tamaño: Los solutos de mayor tamaño, tienen mayor peso molecular. Cuando el tamaño del soluto se aproxima o excede el tamaño del poro de la membrana, su paso a través de ella será más difícil.
Mediante estas técnicas se sustituyen las funciones de filtración glomerular y parcialmente la función tubular, aunque no sustituyen las funciones endocrinas.
Los principios físicos en los que se basan las TCDE son difusión, ultrafltración, convección y adsorción.
DIFUSIÓN
Es el mecanismo a través del cual los solutos pasan a través de la membrana semipermeable que separa dos soluciones de distinta concentración y cuyo desplazamiento se produce a favor de gradientes de concentración.
El líquido de diálisis no contiene determinadas sustancias denominadas detritus, que sí se encuentran en la sangre, por lo que estas sustancias atravesarán la membrana hasta igualarse la concentración en ambos compartimentos.Los solutos pasan a través de la membrana de forma pasiva y sin paso de solvente (agua), se produce por la diferencia de concentración existente a ambos lados de la membrana. Como resultado se consigue el equilibrio de gradiente de concentración entre las dos soluciones separadas por la membrana semipermeable. Para conseguirlo, enfrentamos la sangre del paciente con el líquido de diálisis a contracorriente a lo largo del filtro.
Por lo tanto, se producirá un movimiento de moléculas desde la zona de más alta concentración (sangre) hasta la de menor concentración (líquido de diálisis). La eficacia de la diálisis dependerá de:
- Gradiente de concentración a ambos lados de la membrana.
- Características de la membrana: tamaño del poro, superficie y espesor.
- El tamaño de la molécula: Como más grande sea el peso de la molécula más difícil será su paso a través de los poros de la membrana.
Este mecanismo aclara mejor las sustancias de peso molecular bajo (< 500 Daltons), como la urea y la creatinina.
ULTRAFILTRACIÓN
Este proceso consiste en que una presión osmótica y/o hidrostática empuja el agua a través de la membrana y se extrae sólo líquido sin pretender la depuración de solutos.
La tasa de ultrafltración depende de:
- El gradiente de presión que se ejerce. El volumen de ultrafiltrado depende en gran parte de la presión.
- De la superficie de la membrana.
- Del coefciente de ultrafltración (KUF), es decir el grado de permeabilidad al agua de la membrana. Esta permeabilidad depende del grosor de la membrana y del tamaño de sus poros. La permeabilidad al agua de una membrana se indica por el KUF, que se define como los mililitros de líquido por hora (ml/h)
que traspasan la membrana, por cada milímetro de mercurio (mmHg) de presión transmembrana. Cada membrana tiene su propio KUF. Un KUF de 5 indica que para que se filtren 1.000 ml/h se requiere un gradiente de presión de 200 mmHg. De manera que como más alto sea el KUF menos presión necesita para filtrar.
CONVECCIÓN
El transporte convectivo consiste en el paso de solutos a través de la membrana semipermeable arrastrados por el agua. De manera que se eliminan simultáneamente agua y solutos, en respuesta a la diferencia de presión que existe a ambos lados de la membrana. Pasa líquido del lado de mayor presión hacia el lado de menor presión, arrastrando solutos.
Este paso de agua a través de la membrana permite también el paso de una gran cantidad de solutos que están disueltos en dicha agua. Así se eliminan muchos solutos corporales, pero no se produce una disminución en su concentración. Por eso, la composición electrolítica del plasma es muy parecida a la concentración electrolítica del ultrafiltrado. El ultrafiltrado es el líquido extraído de la sangre a través de la membrana de diálisis a través de estas técnicas. De modo, que la depuración no depende del gradiente de concentración (como en el caso de la difusión), si no sobretodo del volumen de ultrafiltrado.
La cantidad de agua que pasa de un lado a otro de la membrana depende de la presión que se ejerce, por lo tanto, es un transporte activo. El paso de soluto, en cambio, es pasivo, ya que va disuelto en el agua que traspasa la membrana. La cantidad de soluto que se filtra depende de varios factores:
- El peso molecular. Los solutos con un gran peso molecular no pueden atravesar la membrana. Los de menos peso molecular, pasan disueltos en el agua, en la misma concentración.
- La cantidad de ultrafiltrado que se extrae.
- Las características de la membrana.
- Del KUF. La permeabilidad de una membrana al agua se mide por su coeficiente de ultrafiltración, que recibe el nombre de KUF. Como ya hemos dicho anteriormente el KUF se define como el número de mililitros de líquido por hora que traspasa la membrana por cada milímetro de mercurio (mmHg) de gradiente de presión transmembrana.
La convección aclara sustancias de peso molecular pequeño (urea, creatinina, ácido úrico, glucosa, sodio, potasio, cloro, fósforo, etc.), pero también es efectiva con las de peso molecular medio.
ADSORCIÓN
Las membranas con las que están fabricadas los hemofiltros, tienen cierta capacidad de adsorción, es decir, que algunas moléculas quedan “atrapadas” a la superficie de la membrana del filtro. Generalmente adsorven toxinas endógenas o exógenas y también algunos mediadores inflamatorios. Se podrían utilizar en el tratamiento de las intoxicaciones y pacientes sépticos, aunque su eficacia está discutida.
6.TIPOS DE TCDEC
ULTRAFILTRACIÓN CONTINUA LENTA (SCUF)
El objetivo de este tratamiento es extraer el exceso de líquido en pacientes críticos, de forma lenta y continuada mediante la ultrafiltración. No se pretende la eliminación de soluto. Por lo tanto, no se repone con ningún líquido de sustitución. Es decir, no se utiliza ni líquido de diálisis ni de reposición. El flujo de sangre que se suele utilizar oscila entre 50-100 ml/min. Para el ultrafiltrado se suele programar entre 2-5 ml/min. de extracción.
Permite el control de fluidos en situaciones de sobrecarga hídrica (ICC resistente al tratamiento convencional).
HEMOFILTRACIÓN VENO-VENOSA CONTÍNUA (CVVHF)
Es la técnica continua de reemplazo renal más utilizada en las unidades de críticos en España. Consiste en la filtración de soluto arrastrado por el agua a través de la membrana por transporte convectivo y la extracción de líquido a través de la ultrafiltración. En este caso, sí será necesario reponer líquidos, para conseguir un balance hídrico adecuado para el paciente, ya que se extrae más volumen del que realmente queremos eliminar. Esta reposición puede ser prefiltro o postfiltro. La reposición prefiltro es menos eficiente, ya que la sangre se diluye con el líquido de reposición antes de entrar en el filtro.
Con esta terapia conseguimos depurar tanto pequeñas moléculas (urea, creatinina, fosfatos e iones) como moléculas de mayor peso molecular. Puede ser muy útil en IRA, hiperkaliemia, sepsis, intoxicaciones y grandes quemados.
HEMODIÁLISIS VENO-VENOSA CONTINUA (CVVHD)
Se utiliza la difusión como mecanismo de depuración de soluto, y la ultrafiltración para eliminar volumen. Con este tratamiento se necesita líquido de diálisis que entra en el filtro de forma continua, a contracorriente del flujo sanguíneo. De esta manera, conseguimos enfrentar el líquido de diálisis con la sangre a través de una membrana y el paso de soluto se produce por diferencia de gradientes de concentración. Con esta terapia se depuran sobretodo moléculas pequeñas (urea y creatinina), no es tan eficaz para moléculas medianas.
La pérdida de agua a través de la membrana es pequeña por lo que no será necesaria la reposición de volumen. Es decir, en este caso, sólo se utiliza líquido de diálisis.
HEMODIAFILTRACIÓN VENO-VENOSA CONTINUA (CVVHDF)
Con este tratamiento intervienen los dos mecanismos que conocemos, el transporte por difusión y por convección, además de la ultrafiltración para eliminar volumen.
Gracias a la difusión podemos eliminar moléculas de bajo peso molecular (menores a 500 Daltons), y a este proceso se le añade el mecanismo convectivo que elimina eficazmente moléculas de mayor tamaño (por encima de 1000 daltons).
La alta tasa de ultrafiltración (extracción de líquido) hace necesaria la reposición de líquidos. Por lo tanto, con esta terapia utilizaremos líquido de diálisis y de reposición.
7. CATÉTERES Y ACCESOS VASCULARES
7.1 Introducción
El catéter se puede definir como un “tubo de material biocompatible que nos permite llegar a una vena de gran calibre con un buen flujo de sangre y utilizarlo para fines terapéuticos”.
En los años 50 Seldinger desarrolló la técnica de cateterización percutánea de los vasos sanguíneos. Consiste en la introducción de una guía metálica flexible, por la luz de la aguja con la que se ha realizado la punción del vaso sanguíneo. Se retira la aguja, dejando sólo la guía. Después se introduce el catéter que queremos utilizar a través de la guía, que finalmente se retira. Así el catéter queda en el interior del vaso sanguíneo.
En los años sesenta, Quinton y Scribner idearon un sistema que consistía en 2 cánulas, una insertada en una arteria y la otra en una vena próxima.
En 1961, Shaldon desarrolló la canulación de arteria y vena femorales para diálisis y, posteriormente, la utilización de catéteres de doble luz.
Con el tiempo fue aumentando la demanda de catéteres para la realización de TCDEC, y con los avances tecnológicos se fueron utilizando diferentes materiales para la fabricación de estos catéteres y nuevos diseños para minimizar los riesgos y mejorar la eficacia de los tratamientos.
Se puede afirmar que el catéter es un componente clave para la correcta realización de las TCDEC. Sin un buen catéter y sin un buen acceso vascular que garantice un buen flujo de sangre, no será posible llevar a cabo ninguno de estos tratamientos, e insistir en ello, sólo significará una pérdida de tiempo y material y supondrá una sobrecarga de trabajo para el personal de enfermería.
7.2 Tipos de catéter
POR SU USO
- Permanentes o tunelizados: este tipo de catéter se escoge para utilizarlo durante un largo periodo de tiempo, pueden durar hasta 5 años. Dan menos problemas de infección. Se usan en pacientes con insuficiencia renal crónica con los que no se puede usar, por algún motivo, la fístula arteriovenosa (FAV).
- Temporales o no tunelizados: Son los más utilizados en las Unidades de Cuidados Intensivos. Su duración media es de 3 semanas.
SEGÚN EL NÚMERO DE LUCES
- De 1 luz: Antiguamente se usaban 2 catéteres de 1 luz, para canalizar una vena y una arteria para realizar las técnicas arteriovenosas, pero hoy en día están en desuso.
- De 2 luces: Son los más utilizados en las unidades de críticos para realizar las TCDEC. Son catéteres de ente 11 y 14Fr.
- De 3 luces: Son catéteres especiales, la tercera luz puede utilizarse para administrar medicación, sueroterapia, nutrición…
POR SU CONFIGURACIÓN INTERNA
- Coaxial: La parte distal del catéter es para el retorno de la sangre o luz venosa. La parte proximal, que contiene varios orificios es para la entrada de sangre o línea arterial.
- Doble D: La parte distal del catéter, con 1 orificio más 3 laterales, es para el retorno o línea venosa. La parte proximal, con 5 orificios, para la entrada de la sangre o línea arterial.
- Cañón de escopeta: La parte distal es para el retorno de la sangre, es decir, es la luz venosa. La parte proximal consta de un solo orificio y es para la entrada de la sangre (luz arterial). Este tipo de catéteres son los más utilizados actualmente en las unidades de críticos, ya que disminuyen la formación de fibrina en los orificios de entrada y salida y permiten un buen flujo de sangre, con baja resistencia al retorno, disminuyendo así las presiones de entrada y salida.
POR SU FORMA
- Curvos: Están indicados para las yugulares o subclavias, además resultan más cómodos para la movilidad del paciente si éste no está sedado.
- Rectos: Se pueden utilizar para cualquier vía, yugular, subclavia o femoral.
POR SU COMPOSICIÓN (MATERIAL)
- PVC (Cloruro de polivinilo): Cada vez se usan menos porqué son poco biocompatibles y demasiado rígidos, lo que favorece los traumatismos vasculares y las infeciones.
- Poliuretano: Son los más utilizados en las unidades de críticos, ya que son biocompatibles y facilitan su colocación y permanencia, ya que son duros para
su inserción, pero se ablandan una vez insertados, adaptándose a la anatomía del paciente. Tienen menos tendencia a complicaciones trombóticas.
- Silicona: Son los más biocompatibles y por eso se utilizan en catéteres permanentes. Son muy flexibles y duraderos, con menor incidencia de infecciones.
POR SU LONGITUD
- De 6 a 12cm: Pediátricos
- De 15 a 20 cm: Estos catéteres están indicados para vías superiores (subclavia y yugular). Hay que tener en cuenta que las vías superiores izquierdas han de ser más largas, para terminar en el atrio derecho. Yugular / Subclavia derecha: 20 cm. Yugular / Subclavia izquierda: 3‐5 cm más.
- De 20 a 24cm: Estos catéteres están indicados para vías inferiores (femoral).
POR SU CALIBRE
- De 6 a 8 Fr: Una luz. Indicados en pacientes pediátricos.
- De 11 a 12 Fr: Dos luces. Indicados para técnicas convencionales de diálisis.
- De 13 a 14 Fr: Dos luces. Son los más utilizados actualmente en técnicas de depuración continua, terminados en cañón de escopeta. Permite mantener unos flujos correctos con bajas presiones.
Además, hay que tener en cuenta la ley de Poiseuille que relaciona calibre y longitud de los catéteres. La ley de fluidos de Poiseuille indica que el flujo de sangre que se consigue con un catéter es directamente proporcional al radio del catéter e inversamente proporcional a su longitud. “Un aumento del 20% en el diámetro del catéter proporciona el doble de flujo de sangre, con unas presiones menores (fujos > 350 ml/min)”. Por ello, los catéteres de 13 Fr son los que más se utilizan actualmente en las TDEC.

Imagen 8 Set de acceso vascular para purificación de sangre extracorpórea

Imagen 9: Catéter de 2 luces

Imagen 10 Cañón de escopeta
7.3 Elección de la vía de inserción
Una vez que se ha elegido el catéter que se va a utilizar según las características del paciente, si es adulto o pediátrico, su tamaño corporal y si se va a pinchar el lado derecho o izquierdo, hay que decidir la vía que se va a canalizar, para ello se tendrán en cuenta varios factores, la situación de cada paciente, la experiencia del facultativo que realiza la punción y la anatomía del paciente. Para realizar las TCDEC es necesario un flujo sanguíneo elevado, entre 200-400ml/min. Por eso, es importante conseguir un acceso vascular que asegure obtener este flujo sanguíneo. La punta de los catéteres de vías superiores (yugular y subclavia) se debe colocar en la unión de la vena cava superior y el atrio derecho, para evitar así recirculaciones. La punta de los catéteres femorales debe situarse en la vena cava inferior. Después hay que comprobar su correcta colocación con una radiografía.
Según las recomendaciones de la ADQI
- En adultos no es recomendable utilizar la vía subclavia, ni en niños la femoral, por el riesgo de trombosis y estenosis.
- Se recomienda utilizar el ecógrafo para canalizar la vía.
- Utilizar los catéteres de poliuretano para las TCDEC.
El catéter se puede girar 180º y también permite utilizar la luz arterial del catéter como venosa y la luz venosa del catéter como arterial. No obstante, está desaconsejado intercambiar el papel de las luces, debido a la recirculación que se produce cuando por el extremo arterial del catéter entra la sangre ya dializada, ya que puede volver a entrar al circuito por la otra luz , siendo de nuevo depurada y ocasionando una disminución en el aclaramiento de las sustancias.
El catéter se mantendrá heparinizado cuando no se utilice, con heparina al 1% en la cantidad que nos indique el propio catéter. La luz venosa es más larga que la arterial, en cada una de las luces se indica la cantidad de heparina que debemos administrar. Si tenemos que reiniciar la terapia, primero retiraremos la heparina del catéter. La manipulación en todo momento del catéter y sus conexiones se realizarán con la máxima asepsia posible.
Hay que evaluar diariamente la necesidad del catéter venoso y retirarlo cuando no sea necesario.
7.4 Procedimiento de inserción
- Comprobar que sea el paciente correcto.
- Informar al paciente de la técnica que se va a realizar.
- Lavado de manos
- Todas las personas presentes deben llevar gorro y mascarilla.
- Preparar el material necesario.
- Para la asepsia cutánea previa a la colocación del catéter, se usará preferentemente una solución de clorhexidina, si no fuera posible, se utilizará alcohol de 70 grados o povidona yodada. El antiséptico debe secarse completamente antes de la inserción, en el caso de la povidona yodada, se tiene que dejar actuar al menos 2 minutos. Si se vuelve a palpar la zona de punción después de la asepsia cutánea, deberá hacerse también de forma aséptica.
- La colocación de catéteres venosos centrales y arteriales debe ser una técnica estéril, con todas las medidas de barrera, es decir, gorro, gafas protectoras, mascarilla, bata, guantes estériles y tallas estériles. Los profesionales que estén ayudando a la persona que realiza la técnica, o estén dentro del box deben llevar también, como mínimo, gorro y mascarilla. Las tallas estériles deben cubrir al paciente de la cabeza a los pies.
- La punción se realiza siguiendo el método Seldinger.
7.5 Complicaciones relacionadas con la inserción
- Punción arterial.
- Arritmias al introducir la guía.
- Embolia aérea.
- Neumotórax.
- Hemotórax.
- Fístula arteriovenosa.
- Hemorragia retroperitoneal.
7.6 Complicaciones relacionadas con la permanencia y cuidado
- Trombosis del catéter.
- Mal funcionamiento: acodamiento, torsión, contacto con la pared del vaso sanguineo, trombosis parcial.
- Recirculación.
- Estenosis venosas.
- Endocarditis.
- Infección del punto de inserción.
- Sepsis o shock séptico.
7.7 Inicio del tratamiento
Hay que seguir los protocolos de cada centro, pero existen unas recomendaciones generales que hay que tener en cuenta.
- Lo primero que debemos hacer antes de iniciar el tratamiento, es retirar el sello de heparina de las 2 luces. Retiramos 3ml de cada una de las luces y se desecha.
- Limpiaremos las 2 luces con suero fisiológico estéril.
- Comprobar la permeabilidad de las 2 luces. Con una jeringa de 20ml, aspiraremos sangre de la luz arterial o de entrada, si se llena en 6s sin dificultad, es porqué la luz es permeable y nos puede proporcionar un buen flujo de sangre. Se introducen los 20ml de sangre por la luz de retorno, debería poder introducirse en 6s sin resistencias. A este procedimiento se le denomina test de flujo. El intercambio de las luces, si nos encontramos con dificultades
para llenar la jeringa de sangre, sólo es una solución temporal hasta que se cambie el catéter, ya que provocará una recirculación y por lo tanto, el tratamiento pierde eficacia.
- Una vez que estén las líneas conectadas, se protegerán las conexiones con unas gasas con antiséptico.
7.8 Durante el tratamiento
- Evitar las manipulaciones en la medida de lo posible.
- Control del punto de punción.
- Control de las conexiones.
7.9 Fin del tratamiento
- Preparar dos jeringas con 20 ml de solución salina 0’9% para lavar las luces.
- Sellar cada lumen del catéter con la cantidad de heparina que indica el catéter. Para ello, se debe administrar la heparina e inmediatamente pinzar la luz, para asegurarnos un sellado correcto. Las luces deben cerrarse son tapones y permanecerán pinzadas hasta que vuelvan a utilizarse.
- Proteger las luces con gasas o cajas de NTP.
8. MEMBRANAS
Las TCDEC han tenido una evolución bastante rápida en los últimos años, y ha estado muy ligada a las mejoras técnicas que se han producido en este campo y a la evolución de los materiales utilizados. En los años 90 aparecieron las membranas sintéticas de alto flujo y alta permeabilidad, que tienen una gran biocompatibilidad y han supuesto un paso muy importante en el desarrollo de estas técnicas. Actualmente son las más usadas en las TCDEC.
Se ha pasado también del sistema arteriovenoso, al sistema venovenoso, primeramente, con 2 bombas hasta la actualidad, con máquinas de 5 bombas.
El filtro debe estar compuesto por membranas biocompatibles, de alta permeabilidad e, preferiblemente, con capacidad de adsorción de sustancias que se deseen depurar.
La biocompatibilidad se puede definir (Maduell Canals, 2005) como «la capacidad de actuar de los materiales, instrumentos, procedimientos o sistemas de una aplicación específca sin producir una respuesta clínica adversa por parte del organismo». En las TCDEC se refiere a la respuesta del organismo al poner en contacto la sangre con los materiales necesarios para realizar este tratamiento. El componente más determinante es la membrana dialítica, aunque también hay que tener en cuenta el resto de componenetes como las líneas, los líquidos de diálisis, las agujas... El contacto de la sangre del paciente con la membrana origina una respuesta por parte del paciente como la activación de la coagulación, la agregación leucocitaria, estimulación de la producción de mediadores inflamatorios o activación plaquetaria. Cuanto más biocompatible sea esta membrana menor será esta respuesta adversa.
La permeabilidad. Las membranas empleadas en las TCDE son membranas semipermeables, permitiendo el paso de agua y de solutos de una forma muy similar a como lo hace un riñón sano, o sea, sin paso de células ni moléculas superiores a los 30.000 Da. La permeabilidad de una membrana se mide por el KUF o coeficiente de ultrafiltrado (Se define como el número de ml/h que se filtra a través de la membrana por cada mm de Hg de presión transmembrana). Las membranas sintéticas que se usan actualmente tienen una alta permeabilidad, es decir tienen un KUF alto. Pueden alcanzar los 15-20-25ml/h/mm Hg de ultrafiltrado con una presión transmembrana (PTM) estándar. Se consideran membranas de baja permeabilidad cuando el KUF está por debajo de 12 y de alta permeabilidad cuando está por encima de 20ml/h/mm Hg.
Por lo que se refiere a la filtración de los solutos, como ya se ha explicado anteriormente, en la difusión, las moléculas pequeñas se filtran dependiendo del gradiente de concentración. Las moléculas más grandes sólo se filtrarán si son más pequeñas que los poros de la membrana, principalmente por transporte convectivo.
La capacidad depurativa de la convección depende de la cantidad de volumen ultrafiltrado y del coeficiente de cribado (sieving coefficient o relación entre la concentración del soluto en el líquido de ultrafiltrado y la concentración del soluto en el plasma).
El sieving coefficient sirve, además, para clasificar la membrana en lo que se refiere a la permeabilidad a los solutos. En las membranas que se usan normalmente, se considera un punto de corte aproximado de 55.000 Daltons (Da) para así evitar la eliminación de proteínas plasmáticas con estos tratamientos, especialmente la albúmina.
Otro factor que interviene en la permeabilidad de la membrana es su superficie.
Adsorción. Se entiende por adsorción, la capacidad de la membrana de retener algunas sustancias. Con la evolución de las TCDEC se comprobó que algunas sustancias habían disminuido en sangre y no se encontraban en el ultrafiltrado, y que por lo tanto se habían quedado en filtro. La capacidad adsortiva no es igual en todas las membranas y va disminuyendo con el uso por la saturación de la membrana. Actualmente, se han comercializado algunos filtros que contienen resinas con capacidad adsortiva específca. Esto ha permitido el tratamiento de patologías como la sepsis o la insufciencia hepática grave.
9. CIRCUITOS
Los circuitos para realizar estas terapias están compuestos por diferentes líneas, sensores de presión, bombas… que hacen posible la salida de sangre del paciente para que pase por el circuito y sea filtrada, y de nuevo se retorne al paciente con las máximas garantías de seguridad. Aunque existen diferentes monitores en el mercado y cada modelo tiene sus particularidades, hay unos elementos esenciales que son comunes en todos los monitores. Además, hay que tener en cuenta, que todas las líneas disponen de clamps, para facilitar la manipulación y aumentar la seguridad, y que cada línea se representa con un color que ayuda a identificarla de manera visual.
LÍNEAS HEMÁTICAS (de entrada y retorno)
- Línea de entrada, aferente o arterial que se representa con el color rojo.
- Línea de retorno, eferente o venosa que se representa con el color azul.
LÍNEA DEL EFLUENTE que se representa con el color amarillo.
LÍNEA DEL LÍQUIDO DE REPOSICIÓN que se representa con el color violeta.
LÍNEA DEL LÍQUIDO DE DIÁLISIS que se representa con el color verde.
10. TOMAS DE PRESIÓN
- Presión de entrada.
- Presión prefiltro.
- Presión de retorno.
- Presión del efluente.
- Presión transmembrana.
Presión de entrada: Es una presión negativa que depende:
- Del estado de la luz arterial del catéter.
- Del estado de la línea de entrada.
- De la velocidad de la bomba de sangre.
Presión prefiltro: Es una presión positiva, de hecho, es la más positiva de todo el circuito, que depende:
- Del flujo de sangre.
- Del estado del filtro.
Presión de retorno: Es una presión positiva, que depende:
- Del flujo de sangre.
- Del estado de la línea de retorno.
- Del estado de la luz venosa del catéter.
En el atraburbujas de la línea de retorno se encuentra un filtro que impide que los coágulos que se generan a lo largo del circuito puedan llegar al paciente, su función es retenerlos, lo que provoca un aumento de la presión de retorno o venosa, que nos avisa de que puede obstruirse totalmente (coagulación del filtro).
Presión del efluente: Puede ser positiva o negativa. Depende:
- Del KUF (Coeficiente de Ultrafiltrado)
- De la velocidad de la bomba de sangre.
- Número de capilares que funcionan en el filtro.
Si la presión del efluente es positiva es porqué el filtro funciona correctamente.
Si la presión del efluente es negativa es porqué se han perdido capilares eficaces dentro del filtro.
Presión transmembrana (PTM): Es una presión positiva. Depende:
- Del flujo del efluente.
La velocidad o flujo de la bomba de efluente afecta directamente a la presión transmembrana. Un aumento de esta presión expresa que se ha coagulado parte de la superficie, y que algunos capilares no son funcionantes.
El control de las diferentes presiones no evitará la coagulación de los filtros, pero si nos permitirán avanzarnos a los posibles problemas e intertar las pérdidas hemáticas del paciente por coagulación de los circuitos y filtros.
Presiones normales del sistema:
Presión de entrada: -50 a -150.
- Si es alta: por desconexión de la línea, exceso de volumen circulante.
- Si es baja: acodamiento de la línea arterial, obstrucción del catéter, velocidad de bomba excesiva.
Presión de retorno: +50 a +150
- Depende del flujo, del estado de la línea de retorno (posibles acodamientos) y del estado del catéter (obstrucción o posible adhesión del catéter a la pared del vaso)
Presión del filtro: +100 a +250
- Es la presión más positiva de todo el circuito. Si es alta puede ser por coágulos en el filtro o catéter.
Presión del efluente: Puede ser positiva o negativa de +50 a -150
- Al iniciar el tratamiento será positiva y puede ir disminuyendo progresivamente hasta hacerse negativa (significa que el filtro se está coagulando)
11. BOMBAS
El monitor dispone de cinco bombas para:
- Sangre.
- Efluente (ultrafiltrado).
- Líquido de Reposición.
- Líquido de Diálisis.
- Anticoagulante.
12. ALARMAS
Sistemas de seguridad:
Detector de aire en la línea venosa posterior al atrapa-burbujas con su clamp de seguridad.
Detector de fugas hemáticas en la línea de efluente. Si se activa es por la rotura de capilares del filtro y el paso de hematíes al efluente.
Sistemas de alarma:
La máquina deberá activar un sistema de alarma sonora y visual, así como las posibles causas que provocan el problema y las soluciones.
Dentro de alarmas del circuito hemático distinguimos:
- Alarma de presión arterial.
- Alarma de presión prefiltro.
- Alarma de presión venosa.
- Alarma de presión transmembrana (PTM).
- Alarma de detección de aire, en la línea venosa.
- Alarma de detección de fugas hemáticas, por rotura de capilares.
Otras alarmas son:
- Alarmas de detección de puertas de bombas abiertas.
- Alarmas de los circuitos de sustitución y de diálisis.
- Alarmas relacionadas con el circuito de anticoagulación.
- Alarmas relacionadas con el suministro de red o del estado de la batería.
13. LÍQUIDOS
Las TCDEC se usan cada vez más en las unidades de críticos. Como ya hemos comentado anteriormente, su principal ventaja con respecto a las técnicas intermitentes es que no se producen cambios hidroelectrolíticos bruscos y de esta manera, evitamos la inestabilidad hemodinámica, el paciente tolera mejor el tratamiento y es más efectivo. Para que la depuración sea correcta, es necesaria una reposición de una elevada cantidad horaria de ultrafiltrado, que se obtiene del paciente, con un líquido con una composición fisiológica y una concentración de sustancias determinada. Este líquido tiene que servir para reponer todos los componentes normales del plasma menos las sustancias que deseamos eliminar.
El objetivo de los líquidos es aproximar el plasma del paciente a lo que debería ser, la composición normal.
En la actualidad, se consigue un mejor control del paciente con el uso de grandes volúmenes de fluidos para reposición y/o diálisis. Esto otorga una gran importancia a la composición de los líquidos.
Las soluciones de reposición/ diálisis deben estar compuestas de agua y iones. La concentración de iones debe reflejar la composición normal del plasma.
Sodio (Na+) 135-145 mEq/l
Potasio (K+ ) 3,5-5 mEq/l
Cloro (Cl- ) 100-110 mEq/l
Calcio (Ca2+) 3-4 mEq/l
Magnesio (Mg+) 2 mEq/l
Bicarbonato (HCO3- ) 25-30 mEq/l
Glucosa (1g/l)
Estas soluciones son estériles y deben encontrarse libres de pirógenos y endotoxinas, en su composición. Las bolsas son portadoras de un puerto de inyección para añadir otras medicaciones si fuera necesario. Después de la reconstitución, se ha demostrado que la solución reconstituida tiene una estabilidad de 24 h.
Los pacientes portadores de TCDEC, deberán tener un control analítico periódico para vigilar la composición del plasma.
Hay que recordar que el potasio…
Entra y sale muy fácilmente a sangre por difusión.
Por convección, con choque contra la membrana del capilar, entra y sale también al plasma del paciente.
La composición ideal máxima del plasma es de 5 mEq/l, por tanto, los líquidos no pueden contener más de 25 mEq por cada 5 litros de solución.
Se recomienda que las bolsas de los líquidos contengan toda la misma concentración de potasio para evitar errores y desajustes.
Hay que recordar que el bicarbonato…
Viene separado de la bolsa grande y es necesario mezclarlo antes de su administración.
Precipita con facilidad con el calcio.
Si no se mezcla, provocará un mal funcionamiento de la báscula.
Líquido de diálisis
Cuando nos interesa depurar gran cantidad de sustancias de bajo peso molecular, se utiliza el mecanismo de la difusión, la terapia escogida será la hemodiálisis. Para ello se necesita un líquido de diálisis que, por diferencia de gradientes de concentración, haga posible el paso de soluto a través de la membrana. En este caso no hay una pérdida significativa de agua plasmática del paciente. Se necesita un líquido de diálisis que reponga las sustancias que queremos mantener, pero que no contenga las sustancias que se pretenden eliminar.
En el caso de la hemodiafltración, en la que se unen los dos mecanismos de eliminación (difusión y convección), la composición adecuada para cada uno de los líquidos es la misma que cuando se usan por separado.
Líquido de reposición
Uno de los mecanismos de depuración de estas terapias es la convección. Mediante la convección y por una diferencia de presión que se ejerce en uno de los compartimentos del filtro, se produce la eliminación de gran cantidad de agua
plasmática del paciente, que arrastra solutos. A más agua plasmática filtrada, más solutos eliminados.
Normalmente, se intenta seguir la relación de depuración de 35 ml/ kg/h , lo que supone reponer una gran cantidad de líquido (en un paciente de 70Kg, una reposición horaria de 2.450ml/h). Este líquido debe aproximarse a lo que sería la composición ideal del plasma.
Debemos evitar cualquier manipulación, ya que se administran directamente al torrente sanquíneo, para mantener así su esterilidad.
Reposición postfiltro
Es la opción ideal para administrar el líquido de reposición. El inconveniente es que puede producirse una hemoconcentración en el filtro por la cantidad de agua plasmática que se elimina de la sangre, lo que puede favorecer la coagulación del filtro.
Reposición prefiltro
En este caso la reposición se realiza antes de llegar al filtro, disminuye la hemoconcentración, pero puede producir una disminución en la eficacia de la depuración de solutos.
Reposición prefiltro y postfiltro
Con las máquinas actuales la reposición se puede realizar de manera simultánea pre y post filtro, cuando se trabaja con hemofiltración, aprovechando así las ventajas que ofrecen las dos opciones.
14. CALENTADORES
Los pacientes con terapias de depuración extracorpórea sufren una bajada de temperatura, debido al circuito extracorpóreo y a la gran cantidad de líquidos que se administran. Por eso, los monitores, en la actualidad, disponen de un calentador para calentar los líquidos o calentar la sangre. En el caso de que la máquina no disponga de ello, se deben utilizar mantas térmicas para evitar la hipotermia.
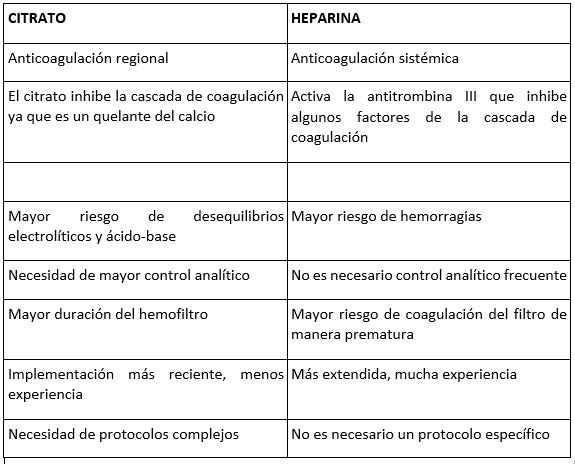
15. ANTICOAGULACIÓN CON HEPARINA
La coagulación de los circuitos es la complicación más común cuando se realizan TCDEC. Es un problema serio ya que produce una pérdida de recursos, una carga de trabajo adicional para el personal, una pérdida de sangre del paciente y una disminución en la eficacia del tratamiento, debido a las interrupciones. Se estima que un set puede utilizarse hasta 72h, pero muchas veces no alcanzan este tiempo porqué se coagulan. Por esto, se hace necesario el uso de anticoagulación en el circuito durante la terapia. La elección del anticoagulante y su dosis dependerán de las características del paciente. En la mayoría de los casos, se elige la heparina Na como anticoagulante. Normalmente se ceba el circuito con una solución con heparina Na (5000 U/ l). Y además se deja una perfusión continua a dosis bajas (de 5 a 10 U/kg/h). Normalmente los monitores de TCDE llevan incorporada una bomba específica para ello. La anticoagulación de la sangre con citrato sódico o ácido cítrico dextrosa (ACD) es una de las últimas novedades, muy útil cuando, por las características del paciente está contraindicado usar heparina Na. Consiste en la utilización de citrato que se administra cuando la sangre sale del paciente, para quelar el calcio en el circuito y así mantener la sangre descoagulada en el mismo. Este efecto se revierte administrando calcio antes de retornar la sangre al paciente.
16. ANTICOAGULACIÓN CON CITRATOS
16.1 Introducción
Como ya hemos comentado, en las técnicas de reemplazo renal es necesario anticoagular el circuito, para alargar la vida del filtro y evitar su coagulación lo que significaría pérdidas de sangre para el paciente, más trabajo y aumento de los costes.
La heparina Na es el anticoagulante más utilizado ahsta ahora, aunque se asocia con un riesgo de sangrado y está contraindicado en algunos pacientes. Ante este problema se han desarrollado otras alternativas, la más utilizada es la anticoagulación regional con citratos (ARC).
16.2 ¿Cómo funciona el citrato?
El calcio iónico juega un papel fundamental en la cascada de coagulación de la sangre. El citrato es un quelante del calcio, por lo que, si el citrato es capaz de “secuestrar” el calcio iónico, libre que hay en la sangre, se desactivará la cascada de coagulación.
La anticoagulación con citratos consiste en la administración continua de citrato en el circuito extracorpóreo, justo a la salida de sangre del paciente, antes de la bomba de sangre. Cuando el citrato se mezcla con la sangre, se produce la unión con el calcio iónico, formando un complejo Ci-Ca, de esta manera disminuye el nivel de calcio iónico en la sangre del circuito. Al final del circuito, para no provocar una hipocalcemia al paciente se repone en administración continua el calcio para restaurar el estado de coagulación fisiológico. Es necesario realizar controles analíticos regulares durante la terapia, para comprobar los niveles tanto del paciente como de la máquina, y ajustarlos si hace falta.
16.3 Indicaciones y contraindicaciones
Indicaciones:
- Alto riesgo de sangrado.
- Trombocitopenia inducida por heparina.
Contraindicaciones:
- Fallo hepático severo.
- Intolerancia al citrato.
16.4 Soluciones
- Citratos
La concentración de citrato que se suele utilizar es de 3mmol/litro.
- Calcio.
Existen diferentes soluciones comercializadas. Las más utilizadas son:
Gluconato cálcico al 10% en viales de 10 mL contenido efectivo de calcio: 2.23 mmol/10mL (223 mmol/L).
Cloruro c Cloruro cálcico al 10% en viales de10 mL contenido efectivo de calcio: 9,13mEq/10mL = 4.57 /10mL (457 mmol/L)
- Líquido de diálisis
Solución sin calcio:
- Líquido de reposición
Solución sin calcio. En la reposición postfiltro podría utilizarse un líquido con calcio, pero aumentaría el riesgo de coagulación de la línea de retorno.
16.5 Montaje del filtro
El montaje dependerá de la máquina de la que dispongamos. Precisa de un fungible específico para anticoagulación con Ci-Ca y de unas soluciones específicas como ya hemos comentado. Hay que seguir los pasos que nos indica el monitor.
El cebado del circuito se realizará sin heparina.
16.6 Control analítico
Antes de iniciar la terapia con citratos, hay que extraer una analítica del paciente para saber cuál es su calcio iónico basal y corregirlo si fuera necesario hasta niveles normales. La muestra debe extraerse del catéter arterial en el caso de que disponga. Si no es portador de catéter arterial la extracción se realizará de un acceso venoso por el que no se esté administrando cloruro cálcico.
Después de la conexión al paciente deberán realizarse controles analíticos seriados, se recomiendan cada 6h. Del paciente y del filtro. La muestra del filtro deberá extraerse de la línea azul. Así se podrán ajustar las dosis de citrato y de calcio periódicamente.
El citrato es un anticoagulante que cuando entra en el organismo se metaboliza en bicarbonato.
Un exceso de citrato puede derivar en una alcalosis (exceso de bicarbonato en sangre). Para revertir esta situación se podría disminuir el flujo de sangre (disminuye la dosis de citrato) o podríamos aumentar la dosis del líquido de diálisis (aumenta la eliminación del bicarbonato) en un 20%.
Un déficit de citrato puede producir acidosis (déficit de bicarbonato en sangre). Para revertir esta situación podríamos aumentar el flujo de sangre (Aumenta la dosis de citratos) o disminuir la dosis de diálisis (disminuye la eliminación de bicarbonato) en un 20%.
17. CUIDADOS DE ENFERMERÍA
Para el buen funcionamiento y efectividad de las TCDEC, existen unos pasos fundamentales que son, el correcto cebado del circuito, la correcta colocación del set, los controles continuos y los cuidados de enfermería. Es necesario llevar a cabo una monitorización horaria tanto del paciente como de la terapia, mediante una gráfica diseñada especialmente para cuando el paciente es portador de TCDEC
Enfermería es el personal sanitario que pasa 24h al lado del enfermo. Su capacidad para prevenir y/o resolver cualquier incidente es muy importante para poder ofrecer unos cuidados de calidad. Enfermería debe saber interpretar los datos que da el monitor.
Los cuidados de enfermería comprenden:
- Control de las constantes vitales.
- Mantenimiento de la asepsia.
- Control de la perfusión tisular.
- Mantenimiento y manejo del catéter para la TDEC.
- Control electrolítico.
- Movilizaciones.
- Evitar la hipotermia.
- Mantenimiento del circuito.
CONTROL DE CONSTANTES VITALES
Se deben utilizar gráficas de monitorización hemodinámica y gráficas de diálisis, para detectar los posibles problemas, registrarlos y hacer cambios en el tratamiento si fuera necesario.
MANTENIMIENTO DE LA ASEPSIA
Hay que extremar las medidas de asepsia en las siguientes situaciones:
- La canalización del acceso vascular. La inserción del catéter debe ser una técnica estéril.
- El cuidado del punto de inserción del catéter. Seguiremos el protocolo de la unidad sobre el cuidado de vías centrales.
- Las manipulaciones de las conexiones de las líneas con el catéter.
- Las manipulaciones del catéter. Usaremos guantes estériles, gasas y tallas estériles y mascarilla.
- Evitaremos las manipulaciones innecesarias del catéter y las conexiones, para evitar en lo posible, la entrada de microorganismos.
- Lavado de manos antes y después de cada procedimiento.
CONTROL DE LA PERFUSIÓN TISULAR
Hay que vigilar la zona cercana al punto de inserción, para comprobar que haya una buena perfusión. Hay que controlar:
- Temperatura.
- Color.
- Pulsos distales.
- Inflamación, dolor..
MANTENIMIENTO Y MANEJO DEL CATÉTER
Un buen mantenimiento y manejo del catéter es muy importante ya que significará alargar la vida y eficacia del filtro.
- Elección de un catéter adecuado a la vena de elección (calibre y longitud). Se recomienda usar un catéter de doble luz de 13 Fr. de longitud adecuada a la vena de elección y acabado en cañón de escopeta.
- Realizar el test de flujo antes de suturar el catéter.
- En el caso de no empezar la terapia inmediatamente, limpiar y heparinizar ambas luces (con los ml. de heparina que la propia luz indica) para garantizar su permeabilidad y correcto funcionamiento.
- Cada vez que interrumpimos la terapia, lavar ambas luces con 20ml de SF y después heparinizar.
- Al reiniciar la terapia, aspirar la heparina que se ha introducido anteriormente y realizar el test de flujo.
- Si el test de flujo no es correcto, podemos movilizar al paciente, la extremidad, se puede movilizar el catéter, rotar… Si nada de esto funciona, habrá que cambiar el catéter.
CONTROL ELECTROLÍTICO
El objetivo es aproximar el plasma del paciente a la composición normal. Las TCDEC sirven para eliminar solutos no deseados de la sangre del paciente. Pero además de desecharse los solutos no deseados, también se eliminan otras sustancias de bajo peso molecular que atraviesan la membrana del filtro. Para corregir este desequilibrio electrolítico de la sangre, los líquidos que se usan en estas terapias llevan incorporados ciertos iones (Ca2+, Mg2+, Na+, Cl, lactato y HCO3) para reponer estas pérdidas. Por eso es tan importante el control analítico, para detectar estos desequilibrios y corregirlos. Se recomienda realizar una analítica al inicio de la terapia y mientras dure el tratamiento habrá que tener un control analítico en función de las necesidades del paciente. Para realizar la extracción de sangre para estos controles se puede obtener directamente del paciente o a través de la línea de entrada (línea roja) pinchando en la toma de muestras más próxima al paciente, desinfectando primero. Se puede conocer
el estado de la anticoagulación del filtro con una muestra de sangre de la vía de retorno (línea azul) para realizar controles.
MOVILIZACIONES DEL PACIENTE
Estar conectado a una máquina de hemofiltración no debería significar limitar las movilizaciones del paciente, si éstas son beneficiosas para él. Para realizar estas movilizaciones:
- El catéter debe de estar bien fijado.
- Evitar tirones y acodamiento de las luces o líneas.
- Comprobar que las conexiones están bien cerradas.
EVITAR LA HIPOTERMIA
Los pacientes con hemofiltración suelen sufrir una bajada de temperatura, debido al circuito extracorpóreo y al intercambio de líquidos. Para evitarlo, muchas máquinas disponen de un calentador en la línea de retorno y si no es así utilizaremos mantas térmicas.
18. PREPARACIÓN DEL MONITOR
Existen diferentes monitores en el mercado, cada uno con sus características concretas. Hay seguir siempre las recomendaciones del fabricante y de los manuales. Para su correcto montaje hay que seguir cada uno de los pasos que nos muestra la pantalla.

Imagen 11: Hemofiltro Fresenius

Imagen 12: Hemofiltro Prismaflex
Hemofiltro prismaflex vs fresenius
19. MANTENIMIENTO DEL CIRCUITO
Para el buen funcionamiento del circuito se deben tener algunos aspectos en el inicio, transcurso y fin del tratamiento.
19.1. Inicio del tratamiento
- Escoger el tratamiento indicado para nuestro paciente.
- Montaje del filtro siguiendo los pasos que indica la máquina.
- Revisar que estén bien cerradas las conexiones de rosca.
- Llenar la cámara venosa hasta el nivel marcado y lo controlaremos durante el tratamiento.
- Cargar la jeringa de heparina.
- Comprobación del catéter (test de flujo).
- Conectar al paciente.
- En el momento de la conexión, iniciaremos el tratamiento con una velocidad de sangre baja, entre 80-100ml/h y el resto de los flujos se dejarán a 0. Después se irá subiendo la velocidad de la bomba de sangre hasta el nivel pautado por el médico (controlar que las presiones de entrada y retorno están dentro de los límites normales). Después se introducirán el resto de los flujos.
- Registrar todos los datos en la gráfica de TCDEC.
- Es importante conservar la línea en Y que incluye el set.
19.2. Durante el tratamiento
- Registrar todos los datos del tratamiento en la gráfica, sobretodo las presiones. Especial atención a las presiones del filtro >300, a las de la PTM >250 y a la alarma “el filtro se está coagulando”.
- Cambio de bolsas cuando sea necesario. Nos podemos adelantar si fuera necesario.
- Vigilar el nivel de llenado de la cámara venosa.
- Realizar balances mínimos cada 24/h y registrarlo.
- Registrar siempre que se pare el tratamiento por algún motivo como TAC, cirugía, cambio de catéter, coagulación del filtro…
- Recirculación: En el caso de tener que parar el tratamiento por un breve periodo de tiempo podemos utilizar la recirculación. Hay 2 alternativas, recircular con salino o con sangre.
Recirculación
Recirculación con salino:
- Se debe parar el tratamiento y escoger la opción de recirculación con salino.
- Desconectar del paciente la línea de entrada y conectarla a un suero fisiológico a través de la Y, que previamente se habrá purgado (línea en Y que incluye el set y debemos guardar).
- Retornar la sangre al paciente.
- Una vez se haya devuelto la sangre al paciente desconectar la línea de retorno y conectarla a la luz libre de la línea en Y.
- Con las 2 líneas (entrada y retorno) conectadas a la solución salina a través de la Y se puede iniciar la recirculación.
- Lavar y sellar el catéter según el protocolo de la unidad.
- Puede ocurrir que el circuito no quede completamente limpio y la máquina nos avise de detección de sangre en el set. Confirmaremos “sin sangre”.
- La recirculación con solución salina tiene un tiempo máximo, que puede variar según la máquina, normalmente no supera los 120min.
- Cuando podamos reconectar al paciente, se parará la recirculación y seguiremos los pasos que nos indique el monitor. En esta opción la máquina requiere un nuevo cebado.
Recirculación con sangre:
- Se debe parar el tratamiento y escoger la opción de recirculación sanguínea.
- Se desconectan las 2 líneas del paciente y se conectan entre ellas y se puede iniciar la recirculación.
- Lavar y sellar el catéter según el protocolo de la unidad.
- Puede aparecer la advertencia “detección sangre en set”. Pulsaremos el botón de continuar para seguir con la recirculación.
- La recirculación con sangre suele tener un tiempo máximo de 60 min.
- Cuando podamos reiniciar el tratamiento, se parará la recirculación y podemos volver a reconectar las líneas. El tratamiento se reanuda sin necesidad de cebado.
HAY QUE RECORDAR:
- Mientras suena una alarma no se está realizando el tratamiento.
- Cuando la bomba de sangre está parada hay riesgo de coagulación inmediata del filtro.
- Si queremos mover la máquina, podemos desenchufarla sin necesidad de apagarla y volverla a enchufar.
19.3 Fin del tratamiento
- Parar el tratamiento.
- Pinzar la línea de entrada o arterial y la luz arterial del catéter y desconectarlas.
- Lavar la luz arterial del catéter con 20 ml. de suero fisiológico.
- Conectar la línea arterial del circuito a una solución salina con una llave de tres pasos y abrir el suero y la línea de entrada.
- Escogeremos la opción de retorno manual para devolver la mayor parte de sangre al paciente (el circuito quedará de color rosado).
- Al acabar, pinzar la línea de entrada y de retorno. Pinzar también las 2 luces del catéter y desconectarlas.
- Limpiar con suero fisiológico y sellar con heparina según protocolo de la unidad. Colocar los 2 tapones.
- Proteger el catéter según el protocolo de la unidad.
- Desechar el circuito (es recomendable pinzar primero todos los clamps) y las bolsas.
- Registrar el balance real antes de parar la máquina.
20. OPTIMIZAR EL FILTRO
20. 1 ¿Cuál es el tiempo óptimo de duración del filtro?
Los fabricantes no se ponen de acuerdo sobre cuál debería ser la duración del filtro, se establece entre 48 y 72h. En la práctica hospitalaria se suelen hacer servir hasta las 72h, aunque en muy pocas ocasiones aguantan más de 48h. El problema se encuentra en los casos en los que no duran ni 24h, entonces se considera que hay una obstruccción precoz del filtro. Por eso, es importante tener en cuenta todos los factores que intervienen en el aumento de la duración y la eficacia del filtro.
20.2 Acceso vascular y catéter
Hay que seleccionar el acceso venoso y el catéter más adecuado en cada caso.
- La técnica de inserción del catéter debería realizarla un profesional con experiencia.
- Evitar la canalización de la vía subclavia en pacientes con riesgo de estenosis y/o trombosis.
- Seleccionar el catéter adecuado en cuanto a longitud, calibre y terminación, se considera que el calibre es más determinante que la longitud.
20.3 Filtros
Lo ideal sería adecuar la membrana al paciente y al tratamiento que vamos a administrar. Aunque no siempre se dispone de diferentes tipos de membrana en el centro.
Las terapias de alto flujo requieren filtros de mayor tamaño.
La elección de la membrana dependerá del criterio médico.
20.4 Cebado correcto
- Respetar el volumen de cebado.
- Heparinizar el suero con el que se realiza el cebado. (5000ui/ l). Excepto si vamos a usar otro tipo de anticoagulación.
- Si hay dudas sobre si el cebado se ha realizado correctamente (observamos aire en el circuito), repetiremos el cebado.
20.5 Gestión de alarmas
Es importante que los profesionales de enfermería tengan un buen dominio de estas técnicas y sepan actuar con eficacia y rapidez cuando se disparan las alarmas, especialmente cuando se para la bomba de sangre, porqué cuando eso ocurre aumenta mucho el riesgo de coagulación del filtro. Si minimizamos las paradas aumentara la duración del filtro.
20.6 Control de presiones
El personal de enfermería debe conocer cuales son los rangos de presiones adecuados, para conocer así el estado del filtro y del circuito y poder anticiparse a los problemas. Estas presiones deben registrarse a cada hora, lo más importante es observar cual es la tendencia. Así podremos anticiparnos a una coagulación del filtro y retornar a tiempo la sangre al paciente evitándole pérdidas de sangre.
20.7 Anticoagulante
- Elección del anticoagulante más apropiado para cada paciente
- Heparina sódica.
- Heparina de bajo peso molecular.
- Citratos.
20.8 Ajuste del tratamiento adecuado
La fracción de filtración (FF) es la cantidad de suero que se extrae de la sangre que pasa por el filtro, en un periodo de tiempo determinado. Hay que recordar que de la cantidad de sangre que pasa por el filtro no todo es líquido, hay elementos formes.
Para ajustar bien el tratamiento, es importante saber con que FF vamos a trabajar, ya que de ella depende la duración y eficacia del filtro. Lo ideal es trabajar con una FF que no supere el 25%. Si la FF se acercara al 100% dejaría solos en el filtro a las células formes de la sangre, lo que supondría una coagulación inmediata.
FF = flujo UF/flujo plasmático
Flujo UF = extracción líquido paciente + reposición prefiltro + reposición postfiltro.
Flujo plasmático = flujo de sangre × (1 – hematocrito/100) + reposición prefiltro.
20. 9 Reposición
La reposición prefiltro puede servir para prevenir la obstrucción del filtro ya que disminuye la hemoconcentración.
La reposición postfiltro evita coágulos en la cámara de aire.
BIBLIOGRAFÍA
- Cutillas B. Generalidades (Sistema urinario)- Definición del sistema urinario. [Internet]. Enfermera virtual. Barcelona: Col·legi Oficial d'Infermeres i Infermers de Barcelona; 2009. [consultado 10 enero 2021]. Disponible en: www.infermeravirtual.com
- Cutillas B. Vías urinarias (Sistema urinario)- Las vías urinarias extrarrenales. [Internet]. Enfermera virtual. Barcelona: Col·legi Oficial d'Infermeres i Infermers de Barcelona; 2009. [consultado 10 enero 2021]. Disponible en: www.infermeravirtual.com
- Cutillas B. Riñones (Sistema urinario). [Internet]. Enfermera virtual. Barcelona: Col·legi Oficial d'Infermeres i Infermers de Barcelona; 2009. [consultado 10 enero 2021]. Disponible en: www.infermeravirtual.com
- Cutillas B. Riñones (Sistema urinario)-Las nefronas. [Internet]. Enfermera virtual. Barcelona: Col·legi Oficial d'Infermeres i Infermers de Barcelona; 2009. [consultado 10 enero 2021]. Disponible en: www.infermeravirtual.com
- Cutillas B. Riñones (Sistema urinario)-Inervación e irrigación. [Internet]. Enfermera virtual. Barcelona: Col·legi Oficial d'Infermeres i Infermers de Barcelona; 2009. [consultado 11 enero 2021]. Disponible en: www.infermeravirtual.com
- Rouviere H.; Delmás A. Anatomía Humana: descriptiva, topográfica y funcional. 9a ed. Masson, 1988. Williams P. L.; Warwick R. Anatomía de Gray. Salvat, 1992.
- Manzanedo J.D. Alteraciones renales. Màster en cures d´Infermeria al malalt crític. Universitat de Barcelona. 20019-2020.
- Andrés E. Prevención primaria y secundaria del fracaso renal agudo. En: Net À, Roglán A, editores. Disfunción renal aguda en el paciente crítico. Barcelona: Ars Medica; 2009. p. 31---53.
- Torras A. Fisiopatología y diagnóstico del fracaso renal agudo. En: Net À, Roglán A, editores. Fracaso renal agudo. Barcelona: Springer-Velarg Ibérica; 1999. p. 1---19.
- Montoliu J. Prevención y tratamiento del fracaso renal agudo. En: Net À, Roglán A, editores. Fracaso renal agudo. Barcelona: Springer-Velag Ibérica; 1999. p. 59---65.
- Romero M.; Delgado P.; De la Cueva L. Revisión de conocimientos sobre el fracaso renal agudo en el contexto del paciente crítico. Enfermería intensiva. [Internet] 2013 [ Consultado 15 marzo 2021]; 11. Disponible en www.elsevier.es/ei.
- Francisco Javier Gaínza. Nefrología al día. Insuficiencia Renal Aguda. Disponible en: https://www.nefrologiaaldia.org/317. Consultado 2 de marzo 2021.
- Gutiérrez Rodríguez P. TÉCNICAS CONTINUAS DE DEPURACIÓN RENAL EXTRACORPÓREA EN EL PACIENTE CRÍTICO: FUNDAMENTOS Y COMPONENTES DEL SISTEMA DE TERAPIA. TEYS [Internet]. 19 de diciembre de 2020 [citado 31 de marzo de 2021];2(9):14-9. Disponible en: https://tiemposdeenfermeriaysalud.es/journal/article/view/101
- Pérez. A. Técnicas continuas de depuración extracorpórea (TCDE). Màster en cures d´Infermeria al malalt crític. Universitat de Barcelona. 20019-2020.
- Muñoz M. Técnicas continuas de depuración extracorpórea para enfermería. Ed. Elsevier. Barcelona. España. 2012.
- Catalán R.M. Indicaciones de las Técnicas Continuas de Depuración Extrarenal. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Sánchez C. Componentes I: Catéteres, cuidados y manipulación del acceso venoso. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Mateos A. Componentes II: Circuitos, membranas y líquidos. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Ortuño M.; Vallès C. CUIDADOS DE ENFERMERÍA Y COMPLICACIONES MÁS FRECUENTES. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Muñoz M. Optimización de las Técnicas de Depuración Continuas. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Muñoz M. Optimización de las Técnicas de Depuración Continuas. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Camacho F. Anticoagulación del circuito con Citratos. EUE Bellvitge, UB, 13 y 14 de marzo, 2013.
- Catalán M.; Nuvials X. “PROYECTO ITU-ZERO” Prevención de la infección urinaria relacionada con la sonda uretral en los pacientes críticos ingresados en las unidades de cuidados intensivos. Ministerio de Sanidad, Semicyuc, SEEIUC. España. 2018-2020
- Ortuño M. Protocolo “Maneig de Tècniques Contínues de Reemplaçament Renal amb el monitor Multifiltrate Fresenius amb citrat”. Hospital Universitari Joan XXIII. Tarragona. 2020.
- Ortuño M. Protocolo “Maneig de TCRR amb el monitor Prismaflex. Hospital Universitari Joan XXIII. Tarragona. 2019.
