La diálisis peritoneal es una técnica de depuración extracorpórea utilizada en el tratamiento de la insuficiencia renal crónica, basada en el principio de la difusión y la ultrafiltración a través de la membrana peritoneal, que actúa como un filtro semipermeable. Esta modalidad emplea una solución dializante introducida en la cavidad peritoneal mediante un catéter permanente. Los solutos y líquidos indeseables presentes en el plasma del paciente pasan a la solución dializante gracias a gradientes de concentración y presión osmótica, mientras que moléculas más grandes, como las proteínas, permanecen en el torrente sanguíneo. El procedimiento se puede realizar de forma manual (diálisis peritoneal continua ambulatoria) o automatizada mediante cicladoras nocturnas (diálisis peritoneal automatizada). La elección entre estas modalidades depende del estado clínico del paciente, su autonomía y las preferencias personales. Los principales beneficios de la diálisis peritoneal incluyen la preservación de la función renal residual, mayor independencia del paciente, ausencia de accesos vasculares y mejor control hemodinámico al evitar los cambios bruscos de volumen asociados con la hemodiálisis.
La colocación del catéter peritoneal requiere una técnica quirúrgica adecuada, y su cuidado posterior es fundamental para prevenir infecciones como la peritonitis, una de las complicaciones más graves asociadas a esta modalidad. Otros riesgos incluyen la obstrucción del catéter, la fuga de líquido y problemas metabólicos como hiperglucemia o dislipidemia debido al contenido de glucosa en las soluciones dializantes. La indicación de la diálisis peritoneal depende de múltiples factores, como la preferencia del paciente, las contraindicaciones anatómicas o funcionales, y la capacidad del sistema sanitario para proporcionar un soporte adecuado. Está contraindicada en pacientes con cirugías abdominales extensas, infecciones recurrentes en la cavidad peritoneal o hernias no corregidas. El manejo de pacientes en diálisis peritoneal requiere un enfoque multidisciplinario que incluye nefrología, enfermería especializada y soporte nutricional, entre otros. Este enfoque integral busca garantizar un equilibrio entre la eficacia del tratamiento y la calidad de vida del paciente. Aunque no está exenta de riesgos, la diálisis peritoneal ofrece una alternativa viable y efectiva para muchos pacientes con insuficiencia renal, especialmente aquellos con dificultad para acceder a hemodiálisis o que buscan una mayor autonomía en su tratamiento.
1.1 INTRODUCCIÓN
La diálisis peritoneal es una técnica en la que el filtro utilizado para la depuración de toxinas nocivas para el organismo es la propia membrana natural (peritoneo). Esta membrana filtra la sangre de partículas toxicas con la ayuda de un líquido biocompatible. Es una técnica sencilla que se realiza en el domicilio y requiere de un aprendizaje previo. Los pacientes que eligen esta modalidad de diálisis necesitan de un espacio suficiente para almacenar el material y un lugar adecuado y bien ventilado para realizar la técnica.
Es una certeza que la enfermedad renal crónica avanzada ha aumentado a nivel mundial y eso marca la necesidad en la toma de decisiones por parte del paciente sobre su enfermedad y sobre su tratamiento. En enero de 2023, Chan CT et al. [1] en su artículo: Diálisis domiciliaria, conclusiones de una conferencia de controversias sobre la enfermedad renal (KDIGO), detalla que, las modalidades de diálisis domiciliaria, entre las que destaca la diálisis peritoneal (DP), aportan mayor autonomía y adherencia al tratamiento por parte del paciente si las comparamos con otras modalidades dialíticas. A pesar de eso, su utilización a nivel mundial sigue siendo bajo.
Existen múltiples causas asociadas a su uso limitado, como: los recursos locales; los costes; el acceso a la atención médica; las políticas del sistema de salud; el sesgo; las preferencias del paciente; las preocupaciones sobre el estilo de vida individual o las cargas a los cuidadores. Chan CT et al. [1] explican que a nivel clínico todas las modalidades ofrecen resultados similares, pero es cierto que, algunas modalidades ofrecen mayores ventajas que otras. El paciente elige la modalidad atendiendo a sus preferencias en cuanto a calidad de vida, objetivos laborales, características clínicas y, sobre todo, en función al apoyo familiar disponible, entorno adecuado y cuidador. Es muy importante facilitar el acceso universal a la diálisis peritoneal (DP) y expandir su utilización con un liderazgo claro de equipos clínicos informados y motivados.
1.2 EPIDEMIOLOGÍA
La Sociedad Española de Nefrología [2] en su informe sobre la enfermedad renal crónica en España (ERC 2022) concluye que ésta se ha convertido en una epidemia silenciosa mundial por su gran impacto en la Salud Pública y por el desconocimiento de la población hacia ella. En el artículo: Visión general e histórica de la diálisis peritoneal (2018) P. Fontán et al. [3] especifican que a pesar de la evidente evolución coste-beneficio de la diálisis peritoneal (DP), su uso sigue estando por debajo de los objetivos esperados. El panorama a nivel mundial indica por ejemplo en Estados Unidos, una incidencia de la DP que se ha mantenido estable en las últimas décadas y una prevalencia de pacientes que aumentó un 87% entre 2000 y 2016.
A nivel europeo, la tendencia en los últimos años marca un descenso moderado de la prevalencia de pacientes en favor al uso de terapia en DP.
1.3 SITUACIÓN ACTUAL EN ESPAÑA: DIFICULTADES Y RETOS
En España la tasa de prevalencia de la enfermedad renal en sus fases avanzadas, es decir pacientes que requieren hemodiálisis, diálisis peritoneal o trasplante, se encuentra en torno a 1.363 por millón de población, es decir que, ha crecido en esta última década casi un 30% situándose en 2020 en 64.600 personas. Entre 2009-2020 la incidencia de la DP alcanzó el 76% (6,3% por año) mientras que el de la HD apenas se incrementó un 11,5% (0,9% por año). Así mismo, la prevalencia de la DP también aumentó un 25,7% (2,1% por año) en comparación con la HD, que ascendió al 12,2% (1,1% por año), según los datos aportados por la Sociedad Española de Nefrología [2]. Como describen P. Fontán et al. [3] la DP todavía encuentra una dificultad importante ya que, aunque la supervivencia precoz con esta técnica es mayor que con la HD, con el tiempo, el paciente podría llegar a padecer de forma progresiva riesgo cardiovascular (por sobrecarga de volumen), hipertensión y alteraciones metabólicas.
Está claro que existen aún muchas limitaciones de la técnica de DP que hay que mejorar. Seleccionar la idoneidad de los pacientes para esta técnica resulta difícil ya que, hay que identificar claramente las barreras no sólo médicas sino también sociales y familiares. Otro eslabón perdido, es la incidencia de peritonitis y peritonitis recurrentes, que obliga al abandono de la técnica, sin contar las complicaciones de tipo mecánico, estructural y funcional (hernias inguinales y abdominales, fugas, mala posición del catéter, atrapamientos del epiplón, etc…).
Para P. Fontán et al. [3] aplicar buenas prácticas para corregir estas limitaciones desde una perspectiva global permitirá una normalización plena en la utilización de la DP.
1.4 DESCUBRIMIENTOS IMPORTANTES: EL NACIMIENTO DE LA DIÁLISIS PERITONEAL
En el libro: Intervención Enfermera en Nefrología Clínica (2010) Lerma García et al. [4] explican que, los físicos del Antiguo Egipto en el año 1500 a.C. ya describieron las características fisiológicas del peritoneo, cuyas referencias se encuentran en el “Papiro de Ebers”, que es uno de los tratados médicos y farmacológicos más antiguos que se conocen. Hipócrates de Cos (Grecia-460-370 a.C.) fue el primero en observar que los cambios en la orina indican enfermedades de algunos órganos. Areteo de Capadocia (120 -200 d.C.) y Galeno de Pérgamo, trataron el origen de la sangre en orina y los edemas corporales.
En su Tratado de diálisis peritoneal (2021), Montenegro et al. [5] reseñan que, en Roma, otro Galeno (100 a.C.) consiguió observar la cavidad peritoneal a través de las heridas mortales entre los gladiadores.

Muchos fueron los descubrimientos que se realizaron durante siglos sobre la fisiopatología renal y las enfermedades que originan, pero el mayor descubrimiento para la nefrología según Montenegro et al. [5] estaría a punto de producirse cuando en 1717, el cirujano Christopher Warrick consiguió tratar la ascitis a una paciente de 50 años, Jane Román.
Warrick realizaba paracentesis mediante una cánula y después reponía el líquido drenado con una solución a partes iguales de agua fresca de Bristol y vino clarete de Burdeos, calentada a la temperatura corporal.
Sin embargo, será años más tarde, en 1744 cuando Stephen Hales, Dr. En Teología y catedrático de la Royal Society (Sociedad de Ciencia más antigua del Reino Unido), mejora el “método Warrick” y lo convierte en una técnica más “suave” utilizando dos cánulas a la vez: “Uno en cada lado del abdomen, uno de ellos en comunicación con un recipiente lleno del licor medicinal por medio de un pequeño tubo de cuero; este licor fluiría hacia el interior del abdomen a la misma velocidad a la que saliese el líquido ascítico por el otro trócar, el cual se podría variar de forma apropiada y sin ningún peligro de síncope para la paciente”, así lo describía el propio Hales en una carta al secretario de la Royal Society, publicada en las Philosophical Transations. El “método Warrick” mejorado, se convirtió en una cura para la ascitis recurrente.

Imagen 3. Stephen Hales
1.5 APARECE UNA NUEVA TERMINOLOGÍA: ÓSMOSIS, DIFUSIÓN Y DIÁLISIS
De acuerdo con Montenegro et al. [5] en 1807 Dutrochet introduce el término «ósmosis» para describir el paso del agua provocado por los gradientes de concentración de las sales en el interior de las células, llegando a medir la presión ejercida por este transvase de agua, a la que denominó «presión osmótica».
En 1861 el escocés Thomas Graham, habla de «diálisis» para describir la difusión de las sustancias a través de una membrana y observa que una solución de azúcar coloreada situada en el fondo de un vaso de agua se podía extender gradualmente hacia arriba, denominando a este fenómeno como «difusión».
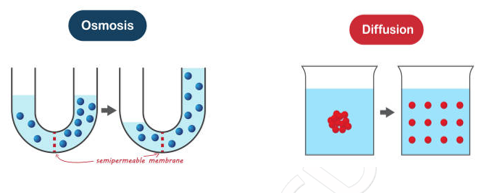
Imagen 4. Osmosis y difusión
En 1877 se inician los primeros intentos de lavados peritoneales, realizados por Georg Wegner con animales, en los que utiliza soluciones salinas frías y observa cómo desciende la temperatura corporal.
1.6 MÁS CONOCIMIENTO SOBRE LA MEMBRANA PERITONEAL
También Montenegro et al. [5] hacen referencia a investigadores como Rosenberg, Engel y Putnam que estudian el peritoneo y su transporte. En 1923 Putnam describe el peritoneo como «una membrana viva» a través de la cual, los fluidos corporales entran en equilibrio con el plasma sanguíneo.
Imagen 5. Membrana peritoneal
1.7 LAS PRIMERAS DIÁLISIS
Lerma García y Serrano Martínez [4] detallan que ese mismo año, en Alemania, Ganter realiza la primera aplicación clínica de la diálisis a corto plazo y describe la peritonitis como complicación, importante hallazgo para la diálisis que aún hoy sigue vigente.
Montenegro et al. [5] describen que, en 1938 Rhoads, trata a dos pacientes urémicos con diálisis peritoneal utilizando por vez primera el método intermitente. Instilando 1,5 litros de líquido de diálisis a través de un simple catéter y extrayéndolo después de un tiempo de permanencia de aproximadamente 15 minutos por el mismo tubo, repitiendo el procedimiento varias veces.
1.8 LARGO CAMINO HASTA LLEGAR AL CATÉTER TENCKHOFF
Nuevamente hay que hacer referencia a Lerma García et al. [4] quienes relatan que, durante la II Guerra Mundial, Kop diseña un catéter con varias piezas que pueden ser esterilizadas y los investigadores Frank, Seligman y Fine, siguiendo las líneas previas de Kop, comienzan el uso de dos catéteres para evitar la obstrucción durante el drenaje. Con este sistema tratan al primer paciente en insuficiencia renal aguda.
En 1959 Doolan y su grupo utilizan por primera vez un líquido de diálisis con una concentración baja de sodio (128 mEq/L), siendo la de cloro igual a la de la sangre (100 mEq/L) y la de bicarbonato de 28 mEq/L y describen el catéter de PVC que presenta unos surcos transversales para evitar que, al doblarse, se ocluyera la luz e impidan atrapamientos del epiplón dejando libre el orificio, como exponen en su libro Montenegro et al. [5]. También destacan que serán Weston y Roberts los que presenten en 1965 un catéter peritoneal en forma de estilete conocido con el nombre de «Trocath». De manera que se podría obtener un acceso temporal y permitiría realizar la técnica que posteriormente sería conocida como “diálisis peritoneal intermitente”. Sin embargo, habría un impedimento y es que las numerosas conexiones y desconexiones ponían en riesgo la esterilidad. Emplearon entonces, dos botellas de cristal de 1 litro de líquido de diálisis para cada intercambio, que se vendían junto con un sistema de administración que era un tubo en forma de «Y». De esta manera, una de las ramas se conectaba al catéter peritoneal y la otra se conectaba a una botella grande en la que podía medirse el total de líquido extraído. Sin embargo, no consiguieron reducir el riesgo de contaminación bacteriana y peritonitis. Tal y como enuncian en su libro Lerma García et al. [4] TencKhoff y Schecter, publicarán en 1968 unos resultados magníficos en pacientes tratados con diálisis peritoneal a largo plazo y que no habían dado muestras de complicaciones infecciosas. Más tarde el propio TencKhoff añadirá al catéter unos manguitos de dacrón afelpado para dar sujeción en la pared abdominal, que forme una barrera de tejido fibroso alrededor contra la infección bacteriana y además evite la fuga de líquido peritoneal.
1.9 LA GLUCOSA COMO AGENTE OSMÓTICO
Montenegro et al. [5] concluyen que, los investigadores Parsons y Moriarty, realizan experimentos con ratas utilizando glucosa hipertónica y prolongando el tiempo de permanencia, pero observan que después de 2 horas y media esta concentración se equilibra a través del peritoneo y parte del agua ultrafiltrada comienza a ser reabsorbida. Además, constatan que la glucosa hipertónica puede lesionar el peritoneo. Sin embargo, desde entonces, y a pesar de haber intentado utilizar otras sustancias con capacidad osmótica, se sigue utilizando la glucosa, ya que es más económica y menos tóxica.
Imagen 6. Solución bicameral para diálisis manual con glucosa 1,36% Baxter® (creación propia)
1.10 LA REVOLUCIÓN DE LAS MÁQUINAS: EL FUTURO EN LA TELEASISTENCIA
A lo largo de los años sesenta se diseñan una serie de máquinas automáticas para la realización de la diálisis peritoneal, que reciben el nombre de “cicladoras”.
A finales de los años setenta, Popovitch y Moncrief y a principios de los años 80 Oreopulos y Nolph demuestran la eficacia de la DP y comienza a generalizarse su uso como tratamiento alternativo en la ERC, según indican Lerma García et al. [4].
Para Montenegro et al. [5] serán Díaz-Buxo y Adams, los que en 1981 modifiquen la diálisis peritoneal con cicladora definiéndola como “diálisis peritoneal continua con cicladora” (DPCC), que consiste en una máquina cicladora automática programada para realizar tres, cuatro o cinco intercambios durante 9-10 horas por la noche. Tras la desconexión en la mañana, se dejan 2 litros de líquido de diálisis en la cavidad abdominal que permanecen allí todo el día, hasta que se realice la siguiente conexión.
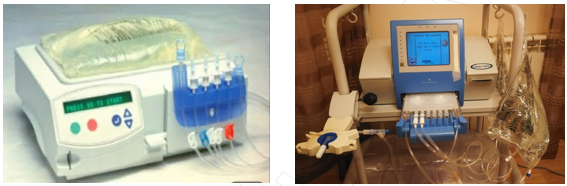
Imagen 7 y 8. Cicladoras Baxter® y Fresenius® (Internet)
Actualmente, existen programas de tele monitorización para la diálisis peritoneal automatizada (DPA) que facilitan la gestión en remoto a los pacientes desde sus domicilios, con un sistema bidireccional y ejerciendo la posibilidad de adecuar la pauta a cada paciente cuando sea necesario.
1.11 FISIOLOGÍA DE LA MEMBRANA PERITONEAL
Fernández- Reyes et al. [6] en su artículo de 2022 sobre la membrana peritoneal, coinciden en que ésta es un tejido semipermeable, vivo y seroso que cubre la superficie de las vísceras abdominales (peritoneo visceral) y la superficie interna de la pared abdominal (peritoneo parietal). Es una cavidad, por tanto, que puede acumular grandes volúmenes.
El peritoneo visceral recibe sangre de la arteria mesentérica superior y el retorno venoso se realiza a través de la circulación portal. El peritoneo parietal se nutre de las arterias lumbares, intercostales y epigástricas y el flujo venoso se realiza a través de la vena cava.
La microcirculación está formada por las células endoteliales de arteriolas y capilares. Cada persona tiene una membrana distinta, con características de transporte diferentes que va cambiando en el tiempo debido al contacto con soluciones cada vez más biocompatibles pero que todavía pueden llegar a lesionarla.
De ahí la necesidad de valorar y evaluar el transporte de agua y solutos cuando se inicia la DP, cuando se presenta un episodio de peritonitis o ante cualquier circunstancia que nos lleve a pensar que la diálisis no está siendo efectiva.
Para Fernández-Reyes et al. [6] el peritoneo está compuesto por una serie de barreras al paso de solutos y agua.
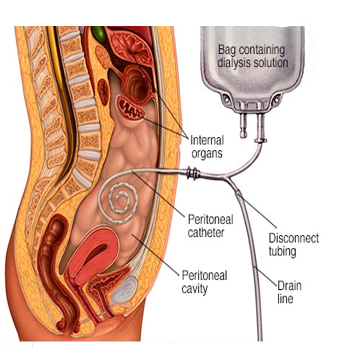
Imagen 9
Una de las barreras más importantes es el endotelio capilar y en él encontramos:

Tabla 1. Barreras del endotelio capilar (creación propia)
1.12 PRINCIPIOS FÍSICOQUÍMICOS EN LA DIÁLISIS PERITONEAL
Fernández-Reyes et al. [6] detallan que, existen tres principios fisicoquímicos en los que se basa la diálisis peritoneal, uno de ellos es la difusión (que es el paso de solutos por diferencias de concentración); otro es la convección (que es el paso de agua por diferencia de presiones) y un tercer proceso de transporte que es el de absorción, mediante el cual diferentes cantidades de líquido y partículas avanzan desde la cavidad peritoneal. El drenaje linfático representa una de las vías de absorción más importantes.
El paso de solutos a través de los poros pequeños se hace por difusión principalmente y dependerá del tamaño de la molécula y de las diferentes concentraciones, así como de la permeabilidad a ambos lados de la membrana. A su vez, existe una correlación importante en cuanto al número y tamaño de los poros de la membrana, de la superficie de intercambio y del grosor del peritoneo. La convección es el principio por el cual se produce el transporte de agua ante las diferentes presiones hidrostáticas y osmóticas. Con la DP se crea un gradiente de presión osmótica a favor del paso de agua desde el exterior hacia la cavidad peritoneal mediante la introducción de un agente osmótico en el líquido de diálisis. El agente osmótico que más se utiliza es la glucosa, concluyen Fernández-Reyes et al. [6].
1.13 TRANSPORTE DE AGUA
Una vez más, nombramos a Fernández-Reyes et al. [6] ya que en su artículo indican que, el agua se transporta a través de los poros pequeños y espacios intercelulares junto con el sodio y otros solutos, pero también pasa a través de las acuaporinas o canales intracelulares de agua. Cuando utilizamos la glucosa como agente osmótico se genera un problema y es que, por su pequeño tamaño, cuando las permanencias son largas se reabsorbe hacia el interior por lo que se pierde capacidad osmótica. Este fenómeno se ha de tener en cuenta en aquellos pacientes que poseen un peritoneo de alta permeabilidad.
1.14 CÓMO EVOLUCIONA EL PERITONEO
Para optimizar las diálisis y evitar daños en la membrana peritoneal Fernández- Reyes et al. [6] proponen que, hay que medir de forma regular tanto la capacidad de transporte difusivo (permeabilidad de la membrana) como el transporte convectivo (capacidad de UF y funcionamiento de acuaporinas) ya que si están alterados se puede comprometer la situación clínica del paciente.
El peritoneo es un tejido vivo que no está diseñado para exponerlo de manera constante a soluciones de diálisis hipertónicas (glucosa) y a episodios de inflamación/infección (peritonitis).
Se ha demostrado que a partir del 4º o 5º año el paciente en DP comienza con una disminución progresiva de la UF y aumento de permeabilidad.
Diversos estudios con biopsias peritoneales han demostrado alteraciones funcionales y cambios histopatológicos inducidos por la glucosa y sus derivados. La cinética peritoneal pretende detectar de forma precoz los cambios en la membrana para optimizar los tratamientos y para prevenir daños irreversibles.
Imagen 10
1.15 MODALIDADES DE DIÁLISIS PERITONEAL: MANUAL Y CICLADORA
En el artículo Modalidades de diálisis peritoneal. Prescripción y adecuación (2022), Bajo Rubio et al. [12] describen que, en la práctica existen dos modalidades de diálisis peritoneal: DP continua ambulatoria (DPCA) que es una técnica completamente manual y DP automatizada (DPA) que emplea una cicladora. El paciente utilizará una técnica u otra en función a sus preferencias personales (laborales o sociales) en función al tipo de transporte peritoneal, persistencia o no de la función residual renal (FRR), calidad de diálisis, etc...
1.15.1 Diálisis peritoneal manual (DPCA)
Bajo Rubio et al. [12] detallan que, con esta modalidad, el paciente se realiza en el domicilio 3-4 intercambios al día. Un intercambio consiste en: un drenaje, una infusión y una permanencia. Cada paciente tiene una pauta diferente y personalizada en función a sus requerimientos dialíticos. Por ello, habrá diferentes volúmenes de infusión, diversos números de intercambios diarios y distintas composiciones de las soluciones de diálisis.
En cuanto al volumen de infusión, en un adulto, lo normal son 2000 ml, siendo menor (si el volumen corporal es menor o si refiere hernias inguinales) o mayor si el paciente tiene gran volumen corporal.
Las permanencias diurnas oscilarán entre 4-6 horas y las nocturnas entre 10-12 horas. De manera que con esta modalidad no se interrumpe el descanso nocturno.
Es una técnica muy sencilla, que precisa de un corto periodo de aprendizaje y que se puede adaptar a las necesidades de cada paciente en función a su actividad diaria. Es la elección de aquellos pacientes que presenten una membrana de baja permeabilidad o bajo transportadores y que requieren permanencias más largas para una diálisis más efectiva.
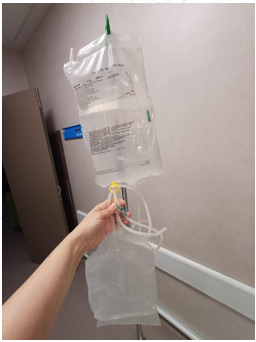
Imagen 11. Solución de Glucosa 1,36% para DP manual (creación propia)
Pero también goza de algunas desventajas como por ejemplo las manipulaciones frecuentes de los puntos de conexión y desconexión (lo que incrementa el riesgo de infección, si no se consigue máxima asepsia); el número de intercambios es limitado y sujeto a la pauta prescrita y por último presenta la desventaja de mayor presión intraabdominal durante todo el día.
1.15.2 Diálisis peritoneal automatizada (DPA)
Es una técnica especialmente indicada para aquellos pacientes altos transportadores que precisan un mayor número de intercambios con permanencias más cortas para conseguir una diálisis y ultrafiltración adecuadas.
Por último, Bajo Rubio et al. [12] concluyen que todas las modalidades de DPA están indicadas en pacientes que necesitan una reducción de la presión intraabdominal, al ser menor el volumen diurno en abdomen o incluso tener día seco. Es la técnica de elección en pacientes que no poseen FRR y en pacientes altos y medio/altos transportadores. paciente se realiza la técnica por la noche. Como desventajas hay que hablar de un mayor coste y que al utilizar una máquina, el tiempo de aprendizaje es mayor y más complejo.
Además, el uso de la Icodextrina en los tiempos de permanencia largos (durante todo el día si tienen día húmedo) permite conseguir mayores ultrafiltraciones que con la glucosa. También hay una ventaja con la DPA y es el menor número de manipulaciones para realizar la técnica y mayor disponibilidad de tiempo libre por el día, ya que, el paciente se realiza la técnica por la noche. Como desventajas hay que hablar de un mayor coste y que al utilizar una máquina, el tiempo de aprendizaje es mayor y más complejo.
Imagen 12. DP automatizada nocturna (Internet)
En base al artículo de Bajo Rubio et al. [12] anteriormente señalado se muestra esta tabla con las diferentes modalidades de DPA.
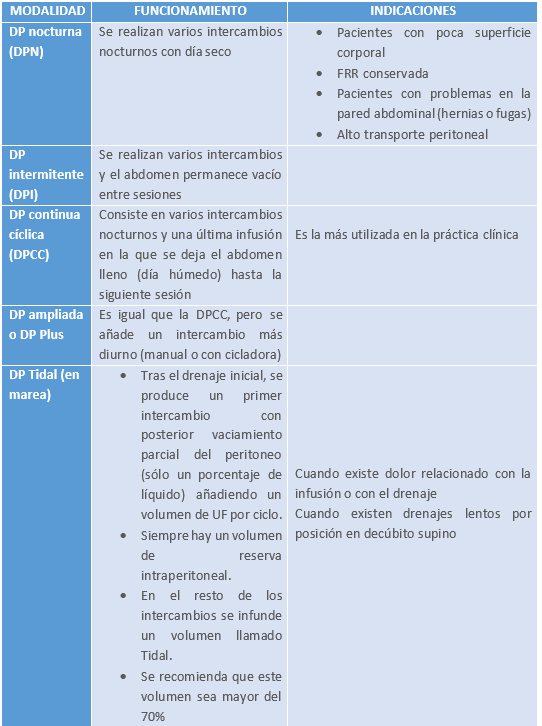

Tabla 2. Modalidades de DP automatizada (creación propia)
BIBLIOGRAFÍA
- Chan CT, Blankestijn PJ, Dember LM, Gallieni M, Harris DCH, et al. Dialysis initiation, modality choice, access, and prescription: conclusions from a kidney disease: Improving Global Outcomes (KDIGO) Controversies Conference. Nephrol Dial. 2020;22(2):152-167.
Disponible en: https://kdigo.org/wp-content/uploads/2017/02/KDIGO-Dialysis-Initiation-conf-report-FINAL.pdf. - Sociedad Española de Nefrología. La enfermedad renal crónica en España [Internet]. 2022.
Disponible en: http://www.senefro.org/ - Fontán P, Rodríguez-Carmona A. Visión general e histórica de la diálisis peritoneal. Nefrología al Día. 2018. Disponible en: https://www.nefrologiaaldia.org/es-articulo-vision-general-e-historica-de-la-dialisis-peritoneal-460
- Lerma García D, Serrano Martínez J. Tema 2: Cuidados de enfermería en la diálisis peritoneal. En: Intervención enfermera en Nefrología clínica. Formación continuada Logoss; 2010.
- Montenegro C, Correa Rotter R, Riella M, Riella M. Tratado de diálisis peritoneal. 3ª ed. Barcelona: Elsevier; 2021.
- Fernández-Reyes MJ, del Peso Gilsanz G, Bajo Rubio A. La membrana peritoneal. Nefrología al Día. 2022.
Disponible en: https://www.nefrologiaaldia.org/es-articulo-la-membrana-peritoneal-230 - Muelas Ortega F. Diálisis peritoneal: concepto, indicaciones y contraindicaciones. Diferentes tipos de D.P. ventajas e inconvenientes. Ciudad de Jaén; 2018. ISBN: 978-84-6948102-8. N.º REGISTRO: 11/93440.
- Arenas MD, Fernández-Chamarro M, Pedreira-Robles G, Collado S, Farrera J, Galceran I, Barbosa F, Cao H, Moreno A, Morro L, Fernández-Martin JL, Crespo M, Pascual J. Influencia de los determinantes sociales de la salud en la elección de tratamiento renal sustitutivo en la enfermedad renal crónica avanzada: necesidad de un enfoque multidisciplinar. Nefrología. 2024;44(4):560-567.
- González Cabrera F, Marrero Robayna S, Vega Díaz N. Materiales para diálisis peritoneal. Nefrología al Día. 2019.
Disponible en: https://nefrologiaaldia.org/es-articulo-materiales-para-dialisis-peritoneal-227. - Lucas Martín Espejo J. Catéteres peritoneales. Tipos de catéteres. Protocolo de implantación de catéteres peritoneales del grupo de D.P. de Andalucía. Revista SEDEN.2012;15(4). Disponible en: https://www.enfermerianefrologica.com/revista/issue/view/253.
- Castillo Rodríguez E, Martin Cleary C, Ortiz A. Soluciones de diálisis peritoneal. Nefrología al Día. 2017.
Disponible en: https://nefrologiaaldia.org/es-articulo-soluciones-de-dialisis-peritoneal-168. - Bajo Rubio A, Rivas B, del Peso Gilsanz G, Fernández-Reyes MJ. Modalidades de diálisis peritoneal. Prescripción y adecuación. Nefrología al Día. 2022.
Disponible en: https://nefrologiaaldia.org/es-articulo-modalidades-de-dialisis-peritoneal-prescripcion-y-adecuacion-466. - Cirera Segura F. Diálisis adecuada. Protocolo de Kt/V. Revista SEDEN. 2020. Disponible: https://formacion.seden.org/publicaciones_articulodet.asp?idioma=&pg=publicaciones_revistadet.asp&buscar=&id=212&idarticulo=2852&Datapageid=33&intInicio=31.
- Cirera Segura F. Tipos de peritoneo. Pruebas funcionales peritoneales. Protocolo del test de equilibrio peritoneal y Kt/V. Revista SEDEN. 2020. Disponible en: https://www.revistaseden.org/files/Articulos_3895_ema1095424.pdf.
- Miembros de la Comisión de Cuidados de la Fundación Hospital Calahorra. Procedimiento de enfermería en el cambio de prolongador en diálisis peritoneal. Versión 0.3. Fecha de revisión (v. 0.1) por la Comisión de Cuidados: 22/06/2017. Fecha de implantación (v. 0.1): 22/06/2017. Fecha de próxima revisión: 2020.
- Montenegro C, Correa Rotter R, Riella MA, Riella MC, Miguel C. Tratado de diálisis peritoneal. 3ª ed. Barcelona: Elsevier; 2021.
- Marenco MT. Continuidad de cuidados en el domicilio del paciente. Rev. SEDEN. 2020.
- González Cabrera F, Marrero Robayna S, Vega Díaz N. Materiales para diálisis peritoneal. Nefrol. al día. 2019.
Disponible en: https://nefrologiaaldia.org/es-articulo-materiales-para-dialisis-peritoneal-227. - Quevedo Reina JC, Marrero Robayna S, Vega Díaz N. Implantación del catéter peritoneal: Técnica percutánea. En: Lorenzo V., López Gómez JM, editores. Revista Nefrología al día. 2022.
Disponible en: https://nefrologiaaldia.org/es-articulo-implantacion-ecoguiada-del-cateter-peritoneal-tecnica-percutanea-459. - Fontán MP, Plaza MM, Velasco MP, Rodríguez-Navarro CQ, Rubio MAB, Sans MB, et al. Guía clínica de la Sociedad Española de Nefrología para la prevención y tratamiento de la infección peritoneal en diálisis peritoneal. Nefrología. 2022; 42:3-58.
Disponible en: https://nefrologiaaldia.org/es-articulo-guia-clinica-de-la-sociedad-espanola-de-nefrologia-para-la-prevencion--469. - Amones Ticona M, Jiménez Barrientos MDR, Marín Valle NE, Valderrama Chávez VDC. Incidencia de infección del orificio de salida del catéter peritoneal con el uso del apósito transparente semipermeable. 2016. Disponible en: https://repositorio.upch.edu.pe/bitstream/handle/20.500.12866/802/Incidencia_AmonesTicona_Maritza.pdf?sequence=1&isAllowed=y.
- Jiménez Jiménez S. Cuidados del orificio del catéter peritoneal. Actuación de enfermería. Complicaciones del orificio de salida. Revista SEDEN. 2020.
Disponible: https://www.revistaseden.org/files/3063_cuidados%20del%20orificio.pdf. - Casas Cuestas R.Complicaciones más frecuentes de la diálisis peritoneal.Revista SEDEN. 2006.
Disponible: https://www.revistaseden.org/files/TEMA%209.COMPLICACIONES%20MAS%20FRECUENTES%20DE%20LA%20DIÁLISIS%20PERITONEAL.pdf. - Estalella L, Rodríguez-Otero C, Garriga J, Doñate T, Targarona E. Hidrocele tras diálisis peritoneal: Persistencia del conducto peritoneo-vaginal. Clin Transl Oncol. 2012;96(6): doi: 10.1016/j.ciresp.2012.05.001.
- Ponz Clemente E, Betancourt Castellanos L. Complicaciones no infecciosas en diálisis peritoneal. Revista SEDEN. 2022.
Disponible en:
https://nefrologiaaldia.org/es-articulo-complicaciones-no-infecciosas-en-dialisis-peritoneal-464. - Tejuca Marenco M. Diálisis peritoneal continua ambulatoria. Enseñanza a pacientes y familiares. Revista SEDEN. 2020. Disponible en:
https://www.revistaseden.org/files/Articulos_3893_ema895002.pdf. - Laguillo de Castro A.Entrenamiento en diálisis peritoneal Automática (DPA).Revista SEDEN. 2020.
Disponible:
https://www.revistaseden.org/files/Entrenamiento%20domiciliario%20en%20diálisis%20peritoneal,%20una%20forma%20más%20lógica%20y%20efectiva.pdf. - Moreno Salinas MM, Sánchez Torres J, Simeón Maragón A, Castillo Jabalera E, Rizo Martínez D, Canales Vitoria AB.Reentrenamiento peritoneal en grupo.Enfermería Nefrológica. 2017; 20:76-76.
- Gómez-González MA. La técnica del espejo. Enfermería Nefrológica. 2014;17(Supl 1):109-115.
Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S2254-28842014000500085. - Aresté Fosalba. Nutrición en diálisis peritoneal. Revista SEDEN. 2020.
Disponible en: https://www.revistaseden.org/files/art257_1.pdf. - Delgado García de Polavieja M, Escribano Loma S, Manso de Real P, Sánchez Tocino ML, Arenas Jiménez MD. ¿Qué novedades aportan en la práctica clínica las guías KDOQI de nutrición después de 20 años? Nefrología. 2022;14(1):1-10. Disponible en: https://www.revistanefrologia.com/en-que-novedades-aportan-practica-clinica-articulo-X1888970022034220.
- Ibeas J, Roca-Tey R, Vallespín J, Quereda C. Guía clínica española del acceso vascular para hemodiálisis. Nefrología. 2017. Vol. 37 (Suple 1):1-177.
- Pérez A, Reque J, Molina P. Manual de hemodiálisis domiciliaria. Sociedad Española de Nefrología. España: 2019. Disponible en:
https://www.nefrologiaaldia.org/es-articulo-hemodialisis-domiciliaria-150 - A, Barril Cuadrado G, Castellano Cerviño I, Martín Reyes G, Pérez Melón C, Slon Roblero F, Bajo Rubio MA. Hemodiálisis domiciliaria en España. Sociedad Española de Nefrología. Revista de nefrología. España: 2015; 35(1): 1 – 124 . Disponible en: https://www.revistanefrologia.com/es-hemodialisis-domiciliaria-espana-articulo-X0211699515055095#tbl1
- Vega Martinez, A. En: Lorenzo V, López Gómez JM (Eds). Hemodiálisis domiciliaria [Internet]. Nefrología al día. ISSN: 2659-2606. Disponible en: https://www.nefrologiaaldia.org/es-articulo-hemodialisis-domiciliaria-150
- Romero Ruiz AB, Serrano Madero E, Crespo Montero R. Estado actual de la utilización de la hemodiálisis domiciliaria: revisión integrativa. Enfermería Nefrológica [Internet]. 2018; 21(1): 63-74. Disponible en:
https://doi.org/10.4321/S2254-28842018000100008 - Nose Y. Home HD: a crazy idea in 1963: a memoir. ASAIO J 2000; 46 (1): 13-17.
- Collins AJ, Foley RN, Chavers B, Gilbertson D, Herzog C, Ishani A, et al. US Renal Data System 2013 Annual Data Report. Am J Kidney Dis 2014;63(1 Suppl): A7.
- Romero Ruiz AB, Serrano Madero E, Crespo Montero R. Estado actual de la utilización de la hemodiálisis domiciliaria: revisión integrativa. Enfermería Nefrológica.2018; 21(1):63-74. Disponible en:
https://enfermerianefrologica.com/revista/article/view/4017 - M.F. Slon, M.A. Bajo, M. González, J. Calviño, A. Pérez, J. Villaro, S. Cigarrán, P. Vidau, S. García, P. Abáigar, E. Coll, A. Gascón, M.J. Espigare, M. D. Molina, P. Molina. Experiencia en España con los primeros pacientes en hemodiálisis domiciliaria tratados con monitores de bajo flujo de líquido de diálisis. Sociedad de enfermería nefrológica. España: 2022; Vol. 42 (4): 363-500. Disponible en: https://www.revistanefrologia.com/es-experiencia-espana-con-primeros-pacientes-articulo-S0211699521001442
- Alonso Nates R. Atención de enfermería en nefrología y diálisis. Ed 1. Madrid: DAE SL; 2013. ISBN: 978-84-92815-52-4
- I. Montesino, E. Bellón, C. Pérez, M. López, I. Villena, A. Ortega. Pacientes 3.0. Enferm Nefrol. 2019; 22(Supl 1): S74-81
