1.1 ANATOMÍA Y FISIOLOGÍA DEL SISTEMA ENDOCRINO
El sistema endocrino está formado por glándulas que vierten su secreción directamente al torrente sanguíneo para que realicen sus funciones en los órganos diana. Las principales glándulas que componen el sistema endocrino son: el hipotálamo, hipófisis, pineal, tiroides, glándulas suprarrenales, gónadas (testículos y ovarios), paratiroides y páncreas.
Además, varios órganos contienen tejido endocrino que, aunque no constituye una glándula endocrina por sí mismo, forma parte de la estructura del órgano en cuestión. Por ello, las glándulas endocrinas y el tejido endocrino constituyen el sistema endocrino.
1.1.1 Anatomía general: estructuras anatómicas
El sistema endocrino y el sistema nervioso trabajan en intima conexión, formando lo que se denomina el sistema neuroendocrino. Todas las funciones del organismo se encuentran reguladas por estos dos sistemas de control. De tal manera que la hipófisis recibe estímulos del hipotálamo y la médula suprarrenal del sistema nervioso simpático. A este sistema se le llama sistema neuroendocrino. Ambos utilizan mensajeros químicos que hacen su efecto en la célula receptora. En el caso del sistema endocrino estos mensajeros se denominan hormonas.
Hormonas
Una hormona es una sustancia química secretada por una célula o grupo de células, que ejerce efectos fisiológicos sobre otras células del organismo. Existen diferentes formas de clasificar las hormonas, siendo la más habitual en función de su composición química. La primera gran división, separa las hormonas en esteroideas y no esteroideas.
- Las hormonas esteroideas: a partir del colesterol (aldosterona, cortisol, testosterona, estrógenos y progesterona).
- Las hormonas no esteroideas: a partir de aminoácidos (GH, TSH, ACTH, FSH, LH, prolactina, MSH, ADH, oxitocina, melatonina, PTH, calcitonina, insulina, el glucagón, la adrenalina y la noradrenalina.

Los tejidos sobre los que hace efecto una hormona se denominan tejidos diana y para que una hormona ejerza su efecto sobre ellos deben tener el receptor apropiado que pueda ser influido por dicha sustancia. Según su acción sobre el metabolismo varias hormonas pueden realizar actividades como:
- Controlar la intensidad de funciones químicas en las células.
- Regir el transporte de sustancias a través de las membranas de las células.
- Regular el equilibrio (homeostasis) del organismo.
- Hacer aparecer las características sexuales secundarias.
- Otros aspectos del metabolismo de las células, como crecimiento y secreción.
Glándulas endocrinas
Las glándulas endocrinas están formadas por grupos de células secretoras rodeados por tejido conectivo o conjuntivo de sostén que les proporciona vasos sanguíneos, capilares linfáticos y nervios. La parte secretora de la glándula está constituida por epitelio especializado que ha sido modificado para producir secreciones y los productos secretados (las hormonas) pasan al espacio extracelular situado alrededor de las células secretoras.
Las glándulas endocrinas del cuerpo humano incluyen: la hipófisis o glándula pituitaria, la glándula tiroides, las glándulas paratiroides, las glándulas suprarrenales y la glándula pineal.
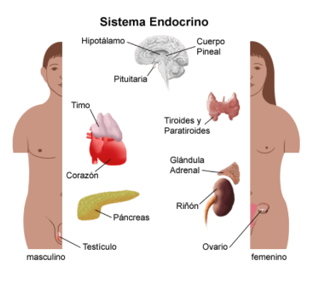
Ilustración 1. Anatomía del sistema endocrino en niños. Fuente: Anatomy of the Endocrine System in Children. Available at: https://www.stanfordchildrens.org/es/topic/default?id=anatomy-of-the-endocrine-system-in-children-90-P05044. Accessed Jun 27, 2024.
Además, varios órganos contienen tejido endocrino que, aunque no constituye una glándula endocrina por sí mismo, forma parte de la estructura del órgano en cuestión. Así sucede en el hipotálamo, el timo, el corazón, el páncreas, el estómago, el hígado, el intestino delgado, los riñones, los ovarios, los testículos, la placenta, o en células del tejido adiposo o de la sangre como los linfocitos.
Es decir, la mucosa gástrica e intestinal produce hormonas involucradas en la digestión y el apetito, como la gastrina, secretina, colecistocinina y grelina. El riñón produce renina, que regula la presión arterial, y eritropoyetina, que controla la producción de glóbulos rojos. El corazón produce el péptido natriurético auricular, que promueve la pérdida de sodio y agua, reduciendo la presión arterial, y actúa como antagonista de la ADH y la aldosterona.
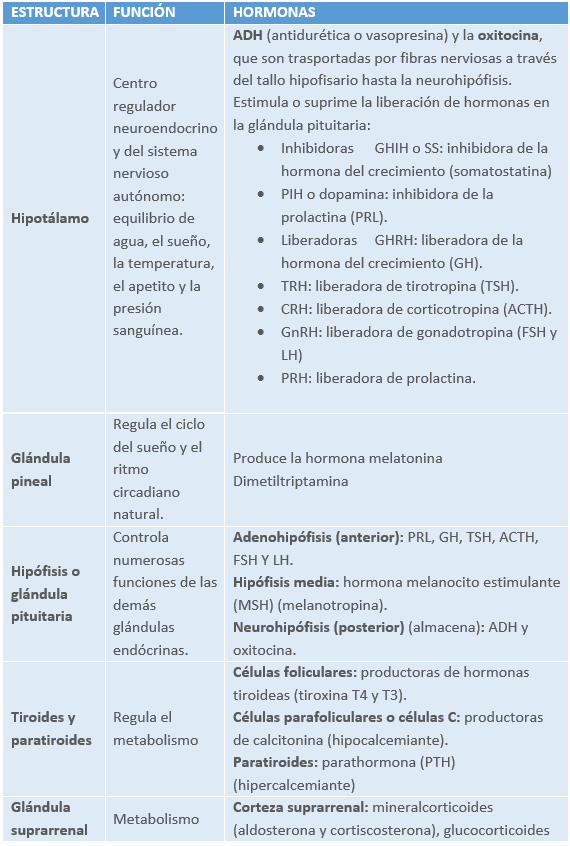

1.2 FISIOLOGÍA ENDOCRINA
El control de la secreción hormonal forma parte de un circuito de retroalimentación (feedback) tanto positivo como negativo. De este modo, es la concentración hormonal la que regula el aumento o descenso en la producción, lo que hace que los niveles hormonales se mantengan en unos límites relativamente estrechos.
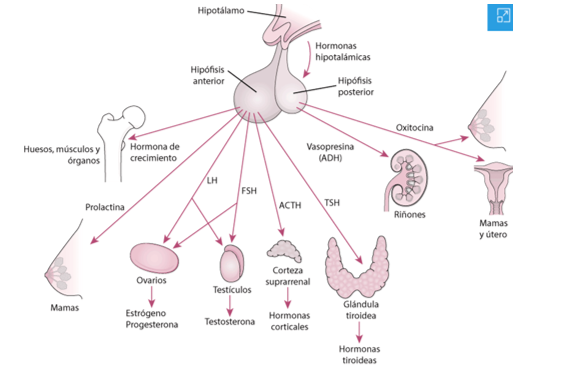
Es decir, el hipotálamo o la hipófisis determinan la cantidad de estimulación que necesitan las glándulas sobre las que actúan mediante las concentraciones de las hormonas producidas por las glándulas que están bajo el control de la hipófisis (glándulas de actuación).
Otro mecanismo que puede regular la secreción hormonal es el sistema nervioso ya que los impulsos del sistema nervioso simpático provocan la secreción de adrenalina y noradrenalina por las glándulas suprarrenales.
La secreción hormonal se puede producir mediante pulsos o picos como es el caso de la hormona GHRH durante el sueño, el ejercicio, el estrés y las comidas ricas en proteínas.
El funcionamiento anómalo de una glándula puede provocar su hiperfunción o su hipofunción, dando lugar a una endocrinopatía:
- Primaria: cuando la anomalía radica en la propia glándula.
- Secundaria: se deben a la afectación de la glándula diana debido a la anomalía en el funcionamiento de la glándula que se encuentra por encima de ella, en este caso la hipófisis.
- Terciaria: cuando el origen del problema se sitúa en el hipotálamo.
1.3 VALORACIÓN DE ENFERMERÍA
La semiología del sistema endocrino en pediatría se refiere al conjunto de técnicas y métodos utilizados para identificar y evaluar las alteraciones en las glándulas endocrinas y sus efectos en el crecimiento y desarrollo infantil.
La historia clínica y el examen físico destacan por su importancia para identificar signos y síntomas relacionados con las disfunciones endocrinas. El crecimiento es la parte más importante en pediatría y endocrinología, es considerado como un signo semiológico que se afecta por muchas patologías. Este crecimiento va a ser distinto según las diferentes etapas del desarrollo debido al control neuroendocrino así como de factores como el ejercicio, el sueño, el estrés, la alimentación y los medicamentos.
1.3.1 Semiología del sistema endocrino en pediatría
La evaluación clínica es fundamental para identificar signos y síntomas de disfunciones endocrinas. Incluye:
Historia Clínica
- Antecedentes Perinatales: diabetes materna, preeclampsia y problemas neonatales.
- Desarrollo y Crecimiento: Evaluación de hitos del desarrollo y patrones de crecimiento.
- Antecedentes Familiares: diabetes, hipotiroidismo o enfermedades autoinmunes.
- Síntomas Específicos: fatiga, cambios en el apetito, peso, poliuria, polidipsia, y alteraciones en el sueño o el estado de ánimo.
Examen Físico
- Crecimiento: Medición de peso, talla y perímetro cefálico, comparados con tablas de crecimiento estándar.
- Desarrollo Sexual: Evaluación del estadio de Tanner para determinar el desarrollo puberal.
- Piel y Cabello: Observación de cambios en la piel (sequedad, pigmentación) y en el cabello (textura, pérdida) que podrían indicar disfunciones endocrinas.
- Tiroides: Palpación de la glándula tiroides para detectar bocio o nódulos.
- Características Faciales y Corporales: Evaluación de características faciales (como macroglosia) y corporales (distribución de grasa, musculatura) que podrían sugerir enfermedades endocrinas.
Pruebas Diagnósticas
- Laboratorio: determinación de niveles hormonales (TSH, T4, cortisol, glucosa, insulina); anticuerpos (presencia de anticuerpos antitiroideos y antiinsulina), y pruebas de estimulación y supresión (Evaluación de la respuesta hormonal tras estímulo o supresión).
- Imágenes: Estudios de imagen como ecografías (tiroides, glándulas suprarrenales y órganos reproductivos), resonancias magnéticas o radiografías para evaluar estructuras glandulares y detectar anormalidades.
- Pruebas Funcionales: Tests específicos como la prueba de estimulación con ACTH para evaluar la función adrenal.
Las principales patologías en pediatría son:
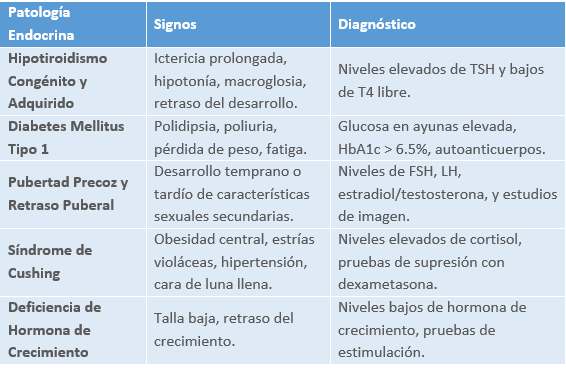
1.4 PATOLOGÍA ENDOCRINA
1.4.1 Cetoacidosis diabética
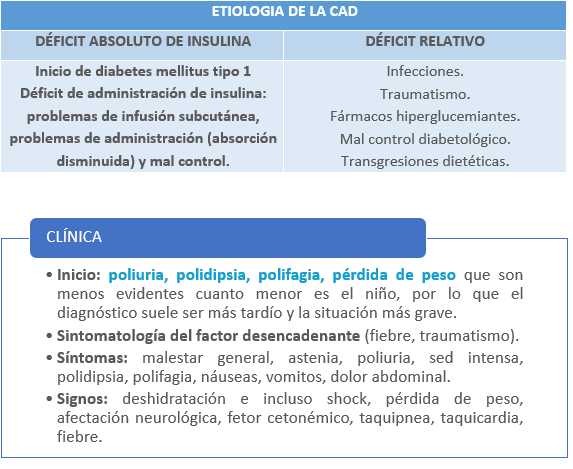
La cetoacidosis diabética (CAD) es el trastorno endocrino – metabólico que produce mayor número de ingresos en la UCIP; es una situación originada por un déficit absoluto o relativo de insulina, el cual se define por la presencia de hiperglucemia (> 200 mg/dl), glucosuria, cetonemia, cetonuria y acidosis.
La CAD constituye la forma de inicio del 25 – 40% de los casos de Diabetes Mellitus tipo 1 (DM1) y de algunos casos de DM2 (<5%). La probabilidad de CAD en casos conocidos de DM1 oscila entre 1 – 10% por paciente y año, siendo mayor en niños con mal control de la enfermedad. Es la complicación más grave de la DM1 y su principal causa de muerte.

La CAD se produce como consecuencia de un déficit de insulina (absoluto o relativo), junto con un aumento de las hormonas contrarreguladoras (glucagón, cortisol, hormona de crecimiento, catecolaminas), que dan lugar a las alteraciones bioquímicas que caracterizan el diagnóstico:
- Hiperglucemia (>200 mg/dl), debido tanto a un aumento de su producción y liberación (hígado, riñón), como a una deficiente utilización periférica.
- Cetonemia y cetonuria: se activa el metabolismo lipídico y la cetogénesis como fuente energética alternativa a la glucosa, con incremento de cuerpos cetónicos.
- Acidosis metabólica.
- Deshidratación y pérdida de electrolitos: por la diuresis osmótica generada por la hiperglucemia. Junto con la pérdida de agua, hay importantes alteraciones electrolíticas, con déficit corporal total de K, Na, P, Ca y Mg.
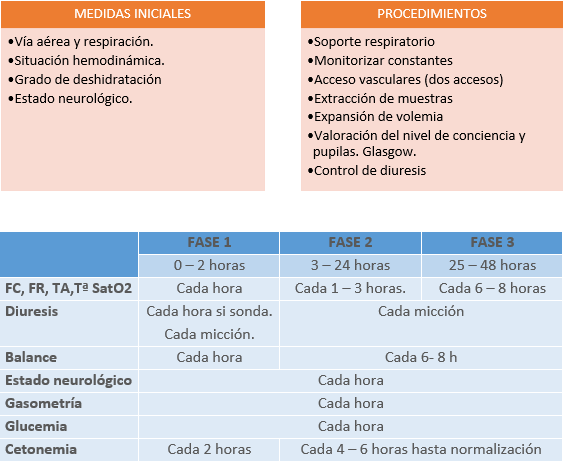
Las primeras pruebas diagnósticas se realizarán simultáneamente con las medidas de estabilización general, valorando de forma rápida el grado de compromiso vital. La gravedad de la CAD se define por:
- La clínica: grado de deshidratación, estado hemodinámico, afectación neurológica. El grado de deshidratación oscila entre un 5 – 7% en la CAD moderada y entre 7 y 10% en la grave, con más repercusión del espacio intracelular.
- La gasometría.
Confirmación diagnóstica, mediante la determinación de:
- Glucemia: >200 mg/dl
- Cetonemia: < 0,5 mmol/L. En la CAD suele alcanzar los 7 mmol/L.
- Cetonuria
- Gasometría: pH < 7,3 o bicarbonato < 15 mmol/L. Aporta datos para el diagnóstico, valoración de la gravedad y la pauta terapéutica a seguir.
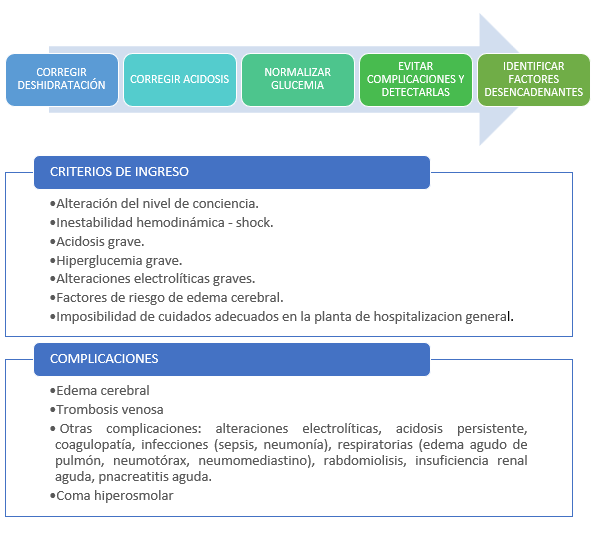
Los objetivos del tratamiento por orden de prioridad son:
1.4.2 Otras alteraciones endocrinológicas en el niño en estado crítico
Insuficiencia suprarrenal aguda
La insuficiencia suprarrenal aguda (ISA) primaria es poco frecuente en niños. La IS funcional es más frecuente y consiste en una respuesta corticoidea insuficiente sin alteración estructural del eje hipotálamo – hipofisario – suprarrenal. El diagnóstico está orientado por la sospecha clínica y la analítica.

La monitorización de este tipo de paciente engloba ECG, FC, TA, PVC, diuresis y temperaturas horarias (riesgo de arritmias). Su tratamiento está basado en el control de:
- Hipotensión: administración de expansiones.
- Hipoglucemias: mantener glucemia > 60 mg/dl.
- Control de hipotermia.
- Deshidratación: corregir la deshidratación mediante aporte de líquidos y electrolitos.
- Tratamiento de glucocorticoides.

Tirotoxicosis
El hipertiroidismo es poco frecuente en la infancia. Su principal etiología es: la enfermedad de Graves, fase hipertiroidea de la tiroiditis autoinmune, adenomas hipersecretores de hipófisis y nódulo tiroideo hiperfuncionante. La clínica se caracteriza por:
- Empeoramiento busco de síntomas de hipertiroidismo (taquicardia, taquipnea, hipertermia, hipertensión, temblores, hiperreflexia, agitación o delirio, crisis convulsivas, diarrea, náuseas, deshidratación, e insuficiencia cardiaca).
- Adolescentes: Fracturas por reabsorción ósea, hipercalcemia e hipertensión intracraneal benigna, etc.
- Recién nacidos: bajo peso, irritabilidad, taquicardia, hiperactividad, exoftalmos, etc.
El tratamiento se basa en la monitorización hemodinámica (FC, ECG y TA) y determinaciones analíticas de hormonas tiroideas y electrolitos, así como:
- Medidas generales: fluidoterapia, medidas de control de la temperatura, sedación y VM.
- Tratamiento farmacológico: antitiroideos, betabloqueantes, corticoides (inhiben la liberación de hormonas tiroideas y disminuyen su conversión periférica).
Hipotiroidismo
Es la endocrinopatía más frecuente en la infancia, sin embargo, es excepcional su diagnóstico en la UCIP, pues es de comienzo lento y raras veces presenta descompensaciones. Sin embargo, si es frecuente como complicación o secuela de lesiones traumáticas, quirúrgicas o infecciosas del SNC en las que se produce un panhipopituitarismo. También puede aparecer en el caso de una tiroiditis autoinmune.
El tratamiento se basa en la administración de L – tiroxina.
Síndrome de enfermedad no tiroidea o Síndrome eutiroideo del enfermo crítico
Este síndrome engloba un grupo de alteraciones tiroideas en pacientes críticos, como consecuencia de una respuesta aguda a una enfermedad sistémica grave y a la restricción de nutrientes. Su etiología no está clara, puede ser un mecanismo de adaptación ante una agresión para prevenir el excesivo catabolismo o el resultado de la agresión sobre el tiroides.
Su prevalencia se encuentra en torno al 45-60% de los niños ingresados en la UCIP. Los pacientes son clínicamente normotiroideos, aunque puede haber un hipotiroidismo central transitorio, por lo que su diagnóstico está basado en la determinación hormonal. El tratamiento con hormonas tiroideas no aporta beneficios y pude ser perjudicial.
1.4.3 Secreción inadecuada de hormona antidiurética (SIADH). Diabetes insípida. Síndrome “pierde sal”
Síndrome de secreción inadecuada de hormona antidiurética (SIADH)
Se define por una secreción de ADH inadecuadamente elevada en respuesta a la hiposmolaridad y/o expansión de volumen del paciente. Es la principal causa de hiponatremia en niños normovolémicos.

La clínica son los derivados de la hiposmolaridad celular:
- Sintomatología general: debilidad, anorexia, náuseas.
- Clínica neurológica: cefalea, somnolencia, letargia, convulsiones, coma.
- Hipertensión arterial tardía.
El diagnóstico se establece con datos clínico – analíticos cuando el paciente presenta hiponatremia con normo o hipervolemia y normalidad de la función cardiaca, renal, hepática, hipofisaria, tiroidea y suprarrenal. El tratamiento se basa en la restricción hídrica asociado con diuréticos y en la administración de suero salino hipertónico en hiponatremia aguda con signos neurológicos graves.
Diabetes insípida (DI)
Se caracteriza por una pérdida de la capacidad de concentrar la orina. Se clasifica en dos: central o neurogénica (DIC), cuando se produce un déficit relativo en la secreción o liberación de ADH; o Nefrogénica (DIN), cuando hay insensibilidad renal a la acción de la ADH.
Es el trastorno hidroelectrolítico más frecuente en el postoperatorio neuroquirúrgico y en el trauma craneal grave. Asimismo, el 40% de los pacientes pediátricos en situación de muerte encefálica presenta DIC. Los signos y síntomas que caracterizan a esta patología son:
- Poliuria – polidipsia.
- Deshidratación hipernatrémica rápida.
- Afectación del SNC: letargia, irritabilidad, convulsiones, coma y muerte.
La prueba diagnóstica se basa en la deprivación acuosa, cuando el paciente está estable; en caso de pacientes críticos, el método fundamental es la observación de la respuesta a la ADH exógena.
El objetivo del tratamiento en la DIC se basa en el control de la diuresis con normovolemia y normonatremia mediante la administración de líquidos para corregir el shock y reemplazar las pérdidas urinarias horarias. Los fármacos utilizados son los análogos de la vasopresina de acción prolongada (desmopresina), y la vasopresina acuosa como alternativa. En la DI nefrogénica se asegura un aporte hídrico con restricción de la ingesta de sodio y administración de diuréticos tiazídicos.
Síndrome “pierde sal cerebral” (SPSC)
Se caracteriza por hiponatremia, hipernatriuresis y depleción del volumen extracelular en pacientes con daño cerebral. Los mecanismos patogénicos es por un aumento de síntesis de péptidos natriuréticos o por una lesión neural con alteración del estímulo simpático del riñón.
Esto dará lugar a una clínica de poliuria e hipovolemia secundarias a un balance negativo, que puede conducir al shock. La hipoosmolaridad puede provocar edema cerebral y aumento de la presión intracraneal con clínica de cefalea, letargia, coma, convulsiones y apnea.

El tratamiento de esta patología se basa en corregir el shock si existe y reemplazar las pérdidas urinarias horarias (SSF o SSH 3%). Debido al déficit mineralcorticoide funcional, el fármaco más empleado es la fludrocortisona, que actúa en el túbulo renal distal aumentando la absorción de sodio y mejorando la hiponatremia.
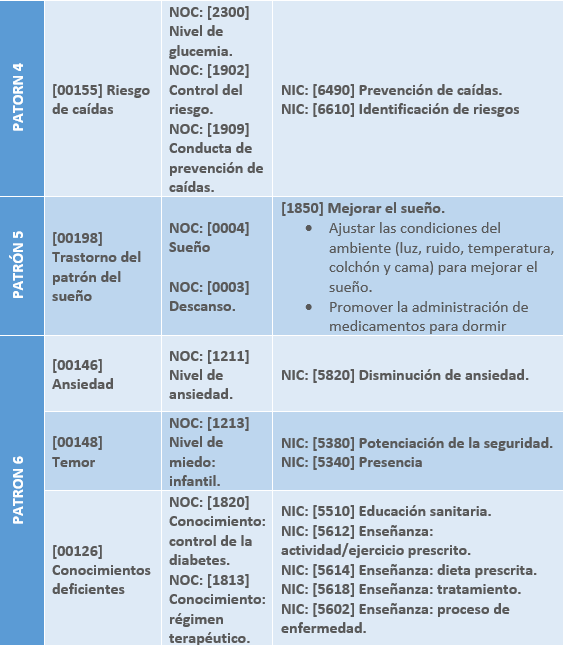
1.5 PLAN DE CUIDADOS DE ENFERMERÍA: NANDA – NIC – NOC
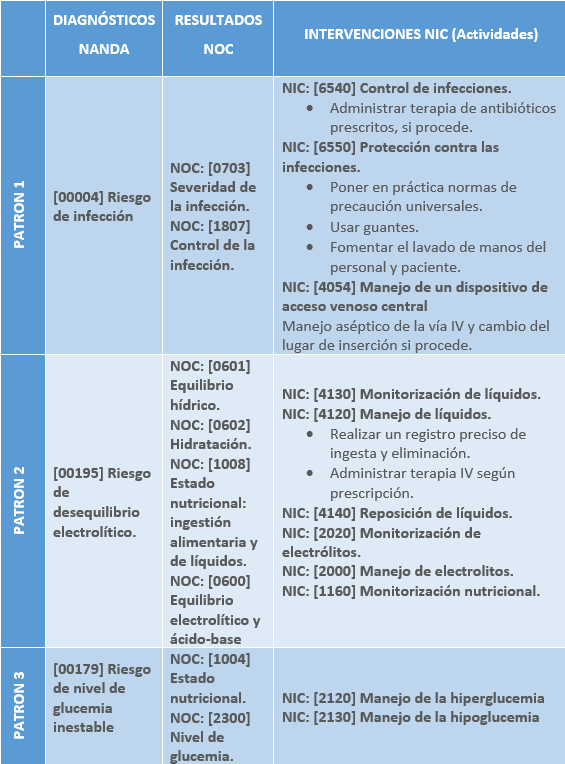
Los principales patrones funcionales de Margory Gordon alterados en el paciente respiratorio son:
- Patrón 1. Percepción – Manejo de la salud
- [00004] Riesgo de infección
- Patrón 2. Nutricional – Metabólico
- [00195] Riesgo de desequilibrio electrolítico.
- [00179] Riesgo de nivel de glucemia inestable.
- Patrón 4. Actividad y Ejercicio
- [00155] Riesgo de caídas.
- Patrón 5. Sueño - Descanso
- [00198] Trastorno del patrón del sueño.
- Patrón 6. Cognitivo – Perceptivo
- [00126] Conocimientos deficientes.
- [00146] Ansiedad.
- [00148] Temor.
1.6 CUIDADOS DE ENFERMERÍA: TÉCNICAS Y PROCEDIMIENTOS
1.6.1 Insulinoterapia
¿Qué es la insulina?
La glucosa es la principal fuente de energía del organismo, para su utilización inmediata, existen mecanismos destinados a mantener estable los niveles de glucemia: la insulina y las hormonas contrainsulares.
La insulina, es una hormona proteica producida por las células beta en los islotes de Langerhans del páncreas, cuya función es mantener normales los niveles de glucemia, por lo que un incremento de los valores de glucosa se sigue de un incremento de insulina.
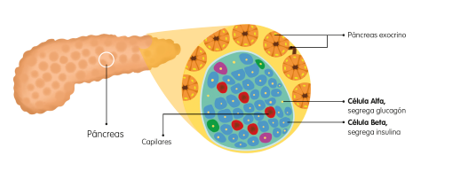
Ilustración 2. Páncreas y células alfa y beta. Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019.
La célula beta libera insulina según dos patrones:
- En situación de ayuno: libera el conocido como “patrón basal”para mantener la glucemia dentro de los límites normales (70 y 100 mg/dl).
- Tras las comidas: libera el “bolo prandial”que suele acompañar a la llegada de nutrientes desde el intestino. Su misión es evitar que la glucemia aumente tras la ingesta y facilitar que los nutrientes se distribuyan en los lugares de almacenamiento.
Por lo tanto, el tratamiento con insulina de la diabetes va a reproducir lo mejor posible estos dos patrones de acción: una que mantenga la glucemia estable entre comidas/ayunas, y otra que evite el aumento de glucemia tras las comidas.
Tipos de insulina
Cualquier tipo de insulina que administremos va a presentar un perfil de acción en el que podremos distinguir varios momentos:
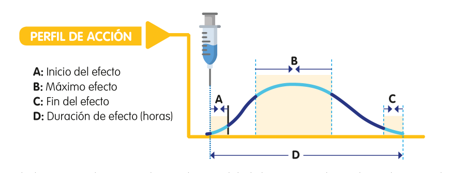
Ilustración 3. Perfil de acción de insulinas. Arroyo Díez FJ.
Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019.
- Inicio del efecto – Inicio de Acción: es el momento en que comienza a disminuir la glucosa en sangre tras la administración de insulina.
- Efecto máximo: es el momento en el que la disminución de la glucosa por la acción de la insulina es mayor.
- Duración del efecto: tiempo de duración de su acción, más allá del cual la insulina no será capaz de controlar la glucemia y esta tenderá a aumentar.
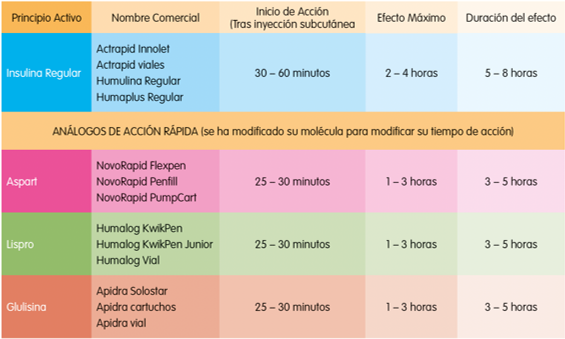
Ilustración 4. Insulinas de acción rápida. Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019.
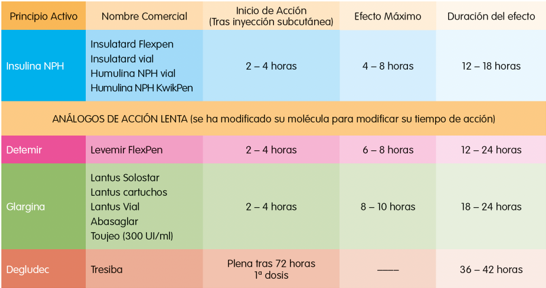
Ilustración 5. Insulinas de acción lenta. Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019.
Vías de administración
Vía subcutánea
La insulina puede ser administrada tanto de manera subcutánea como intravenosa. En el caso de la vía subcutánea, las zonas de administración son: lateral externa de muslos, lateral externa de brazos (por debajo de zona deltoidea), externa (superior de nalgas) y abdomen (evitando el ombligo).
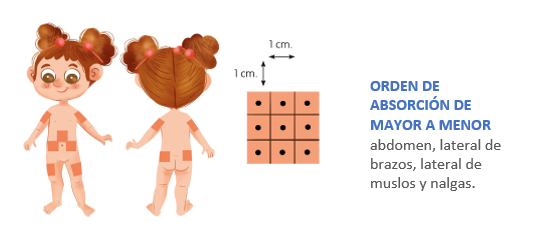
Ilustración 6. Zonas de administarción de insulina.
Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019.
La administración repetida en el mismo lugar de la insulina puede dar lugar a lipohipertrofias, un endurecimiento de la grasa que puede provocar una inadecuada absorción de la insulina. Por ello, se debe de cambiar diariamente el punto de inyección, con una separación de 1 cm, de forma que pase más de un mes entre dos inyecciones puestas en un punto.
Vía intravenosa
La insulina intravenosa se emplea en pacientes de UCI que requieren un control rápido y eficiente de hiperglucemia en situación de emergencia u otras afecciones que afectan a la glucemia. La insulina administrada por vía intravenosa es de acción rápida, ya que podemos (los efectos comienzan a los 30´).
No existe consenso con respecto a cómo debe de ser preparada para su infusión. Por ello, el control sobre esta droga requiere de gran precisión en pacientes pediátricos y neonatos, donde riesgos como la sobredosis se acentúan notablemente.
A pesar de la falta de consenso, existen diferentes recomendaciones que pueden ayudarnos a tener un mayor control sobre esta droga, como veremos a continuación:
- Compatibilidad: reservar un lumen destinado a esta infusión, con el fin de reducir los posibles riesgos de interacción entre las diferentes soluciones. Así como, en caso de utilizar sistemas de prolongación, optar por aquellos que menor espacio común entre las líneas presente (las alargaderas bifurcadas o trifurcadas antes que las rampas o llaves de tres vías).
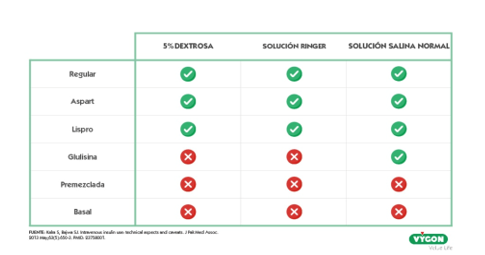
- Adsorción/Absorción: La insulina puede unirse y adherirse a los tubos de plástico de los equipos intravenosos, así como a las superficies de algunos equipos utilizados en la administración de insulina. Entre los diferentes factores que influyen la adsorción de insulina encontramos: material utilizado, concentración de insulina (a menor concentración de insulina en el bolo a infundir, mayor será la adsorción), longitud del recorrido, temperatura, velocidad de infusión (aumentará el riesgo de adsorción cuanto más lenta sea la velocidad de infusión).

- Reflujo: utilizar válvulas antirretorno que eviten el retroceso del flujo o bolos accidentales.
- Monitorización: requiere un seguimiento estricto, control cada hora, siendo posible extender el monitoreo a una frecuencia de dos horas para los pacientes con glucosa estable.
- Transición de insulina intravenosa a subcutánea.
Infusión Subcutánea Continua de Insulina (bomba de infusión continua de insulina, ISCI)
Consta de un dispositivo electrónico que administra insulina, en el que se programan los diferentes parámetros para el cálculo de los bolos prandiales y de la insulina basal que repartirá en 24 horas. La basal la administrará de forma automática, aunque se pueden realizar ajustes temporales puntuales sobre la misma.
Esta opción de tratamiento ha mostrado ser eficaz disminuyendo el número de hipoglucemias y mejorando la calidad de vida. Para su inicio, precisa de un programa de formación específico.
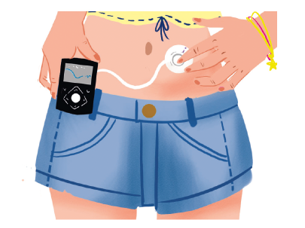
Ilustración 7. ISCI. Fuente: Arroyo Díez FJ.
Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019).
La infusión de insulina se realiza desde un reservorio por la acción del motor de la bomba, a través de un catéter que llega hasta una cánula insertada en la piel (glúteo o abdomen preferentemente). Este sistema de infusión (catéter y cánula) se reemplaza cada 2 o 3 días y puede desconectarse durante un tiempo limitado para realización de actividades que lo requieran.
Sistemas de asa cerrada
Los sistemas de asa cerrada vinculan la monitorización continua de glucosa y una bomba de insulina a un microprocesador que utiliza un algoritmo matemático para ajustar la velocidad de infusión de insulina. El microprocesador reemplaza la toma de decisiones humanas, realiza más ajustes de los que realizaría una persona y reduce el estrés asociado a esa continua toma de decisiones. Aunque el control de la infusión basal es automático, el control de los bolos para las comidas debe todavía realizarlo el propio usuario, accionando la bomba de forma manual.
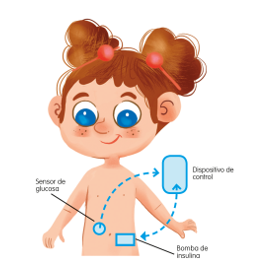
Ilustración 8. Sistemas de asa cerrada.
Fuente: Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019)
1.6.2 Monitorización: glucemia y cuerpos cetónicos
La medición de la glucemia y de los cuerpos cetónicos puede realizarse en orina (glucosuria/cetonuria), usando tiras reactivas, o en sangre (glucemia/cetonemia), utilizando aparatos específicos. Es más precisa las mediciones en sangre, y por ello se aconseja su uso siempre que sea posible.
Glucemia/cuerpos cetónicos capilares

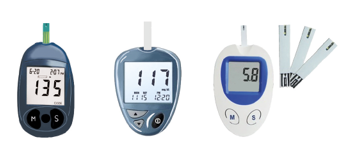
Ilustración 9. Glucómetro y tiras reactivas. Fuente: Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019
En el caso de los cuerpos cetónicos, lo normal es que su medición sea negativa. Se aconseja su determinación cuando la glucemia es superior a 250 mg/dl. La interpretación de los valores de cetonemia es:
- Igual o Inferior a 0,5 mMol/l: negativa (situación normal).
- Valor entre 0,6-0,9 mMol/l: débilmente positiva.
- Igual o superior a 1 mMol/l: positiva. Cuanto más alto sea el valor hay mayor riesgo de evolucionar hacia un cuadro grave de descompensación cetoacidótica.
Monitorización continua de glucosa (MCG)
La MCG es una alternativa a los controles de glucemia capilar que proporciona una imagen más completa de los cambios de glucosa durante el día. Se compone de un sensor, un transmisor y un receptor. El sensor es un filamento flexible que se inserta debajo de la piel en contacto con el tejido celular subcutáneo y tiene una vida media que varía entre 6 y 14 días. El transmisor envía la señal a un dispositivo receptor (monitor, bomba o aplicación del teléfono móvil) para informarnos de la lectura.
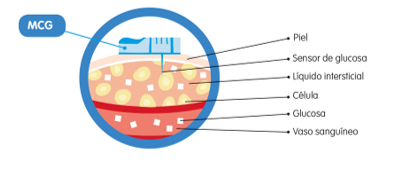
Ilustración 10. MCG.
Fuente: Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019).
Son dispositivos que permiten medir los niveles de glucosa en el líquido intersticial subcutáneo, suministrando información continua sobre las fluctuaciones. Estos permiten su medición cada 5 minutos, y ver su tendencia mediante flechas, que orientan sobre la dirección y la velocidad de cambio de glucosa.
La medición de glucosa en sangre y en tejido intersticial no tienen necesariamente el mismo valor:
- Glucemia estable: los niveles de glucosa en sangre y en el líquido intersticial son similares.
- Fluctuaciones: las diferencias entre ambas medidas se incrementan, de manera que el nivel de glucosa en sangre se refleja más tarde en la intersticial con un promedio de 5-10 minutos. A este tiempo se le llama decalaje, desajuste o desfase de la glucosa.
Actualmente los sistemas de MCG se clasifican en dos grupos:
- Sistema de monitorización flash o intermitente de glucosa intersticial: formado por un sensor que se inserta en la parte posterior del brazo y un dispositivo de lectura. El dispositivo almacena la información obtenida por el sensor y permite obtener valores y tendencias de glucosa intersticial en cualquier momento, acercándolo al sensor, y el trazado de las últimas 8 horas de glucosa.
- No dispone de alarmas. Permite además una lectura retrospectiva de días, semanas y meses al descargar dichos dispositivos en un ordenador, información de mucha utilidad para la persona que los utiliza, así como para el equipo de diabetes que le atiende.
- Sistemas de MCG en tiempo real:aportan información de la glucemia en tiempo real, flechas de tendencia, gráficos de las últimas horas de monitorización e incluso pueden generar alarmas cuando los valores se sitúen fuera de objetivo, o cuando las subidas o bajadas de glucemias son muy bruscas. Algunos necesitan calibrarse 1-2 veces al día, aunque otros modelos más recientes no necesitan calibración.
1.6.3 Control de hipoglucemias e hiperglucemias
Hipoglucemia
La hipoglucemia consiste en el descenso de la glucosa en sangre por debajo de 70 mg/dl con o sin síntomas. Es la principal barrera para obtener un estricto control de la diabetes tipo 1 y es la complicación aguda más frecuente del tratamiento.

Ilustración 11. Clasificación de hipoglucemia.
Fuente: Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019).
Es muy importante tener los conocimientos adecuados para poder evitar las hipoglucemias. Y si ocurren, es fundamental saber reconocerlas y tratarlas lo antes posible. En un organismo sano, cuando los niveles de glucosa bajan, se detiene la secreción de insulina y se liberan hormonas contra-reguladoras, activando el sistema nervioso simpático para liberar glucosa del hígado.
El glucagón es la primera hormona liberada, seguida de catecolaminas, hormona de crecimiento y cortisol, que provocan síntomas como hambre, palidez, sudoración y palpitaciones. Si la glucosa baja demasiado, pueden aparecer síntomas de hipoglucemia en el cerebro, como cambios de comportamiento, desorientación, confusión, convulsiones y potencialmente coma.

Ilustración 12. Sintomatología de la hipoglucemia.
Fuente: Barrios Castellano, R. Diabetes tipo 1 en la edad pediátrica. Lo que se necesita saber para la autogestión de la diabetes (2021).
En la UCIP, para controlar y prevenir la hipoglucemia se siguen dos estrategias principales:
- Monitorización frecuente de la glucemia: La Asociación Americana de Diabetes (ADA) y la Asociación Americana de Endocrinólogos Clínicos (AACE) recomiendan su control cada hora, excepto para los pacientes con glucemias estables (cada dos horas).
- Ajuste de la velocidad de infusión intravenosa: si el nivel de glucosa en sangre disminuye demasiado rápido. Algunos protocolos recomiendan detener temporalmente la infusión de insulina por hipoglucemia y reiniciarla a una velocidad menor una vez que se ha resuelto.
En caso de hipoglucemia con pérdida de conciencia, se administrará una dosis de glucagón mediante inyección (intramuscular o subcutánea). Las zonas más accesibles son los glúteos o muslos.
El glucagón no está preparado para su administración directa (pues perdería su función). Para su preparación, se deben seguir las instrucciones gráficas que aparecen dentro del estuche: introducir el líquido de la jeringuilla dentro del frasco, mezclar y después rellenar de nuevo la jeringuilla. La dosis a administrar va a depender de la edad del niño:
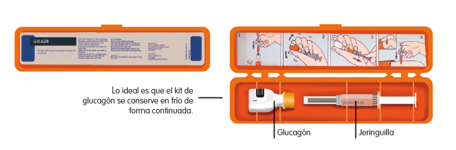
Ilustración 13.Kit de glucagón.
Fuente: Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019).
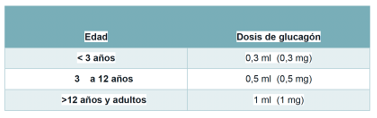
Ilustración 14. Dosis de glucagón.
Fuente: Barrios Castellano, R. Diabetes tipo 1 en la edad pediátrica. Lo que se necesita saber para la autogestión de la diabetes (2021).
El glucagón nasal es una alternativa eficaz dada la no necesidad de preparación y más fácil administración (Baqsimi™). Se han realizado estudios que demuestran su eficacia en adultos y en niños a partir de los 4 años. En el siguiente dibujo se muestra cómo utilizarlo:
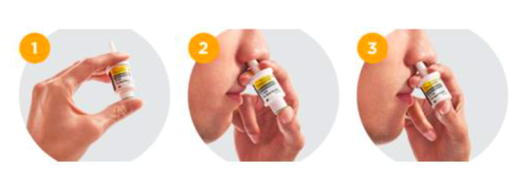
Ilustración 15. Glucagón nasal.
Fuente: Barrios Castellano, R. Diabetes tipo 1 en la edad pediátrica. Lo que se necesita saber para la autogestión de la diabetes (2021).
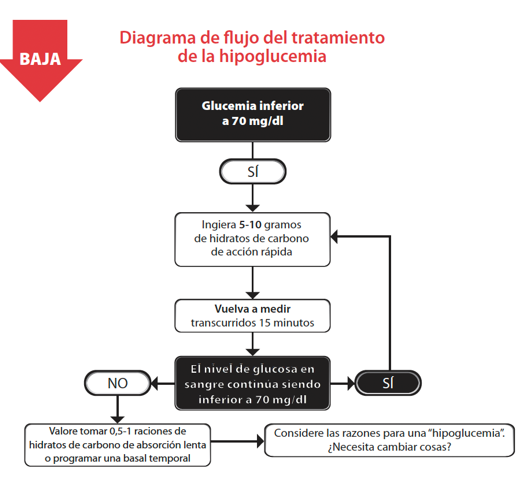
Ilustración 16. Tratamiento de las hipoglucemias.
Fuente: Medtronic.
Hiperglucemia
Es toda glucemia por encima de los objetivos individuales (>180 mg/dl). Como se ha mencionado anteriormente, cuando las reservas de glucógeno se agotan, y no hay glucosa disponible, el organismo necesita aumentar el metabolismo de las grasas para obtener energía, generando cuerpos cetónicos. Por lo tanto, la cetosis puede aparecer por falta de glucosa o por falta de insulina.
Una hiperglucemia aislada/puntual no tiene unos efectos perjudiciales serios inmediatos, pero sí lo tiene la hiperglucemia mantenida en el tiempo. Por ello, una hiperglucemia puede no acompañarse de un déficit importante de insulina (hiperglucemia sin cetosis) o deberse a una falta de insulina (hiperglucemia con cetosis).
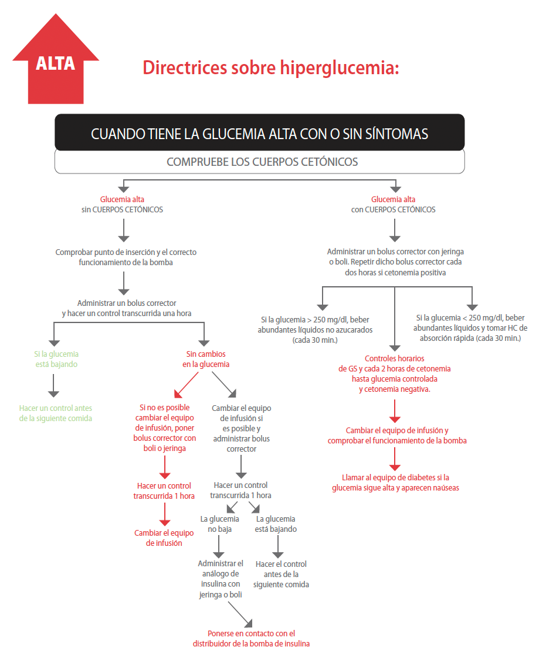
Ilustración 17. Tratamiento de la hiperglucemia.
Fuente: Medtronic.
1.6.4 Dieta por raciones
El método de contaje de HC debe ser introducido desde el diagnóstico de la diabetes. Una ración de HC es la cantidad de alimento que contiene 10 gr de HC. Por ello, se debe de consultar en la tabla nutricional del producto el contenido de HC.
El contaje de HC es de importancia para calcular la dosis de insulina rápida necesaria para cubrir cada ingesta, a esto se le denomina ratio insulina/HC. Al conocer la ratio se procede a contar las raciones o gramos de HC que se van a tomar y se aplica para el cálculo de la dosis de insulina. La ratio es diferente para los distintos momentos del día y debemos adecuarla al tipo de alimento y a cada persona.
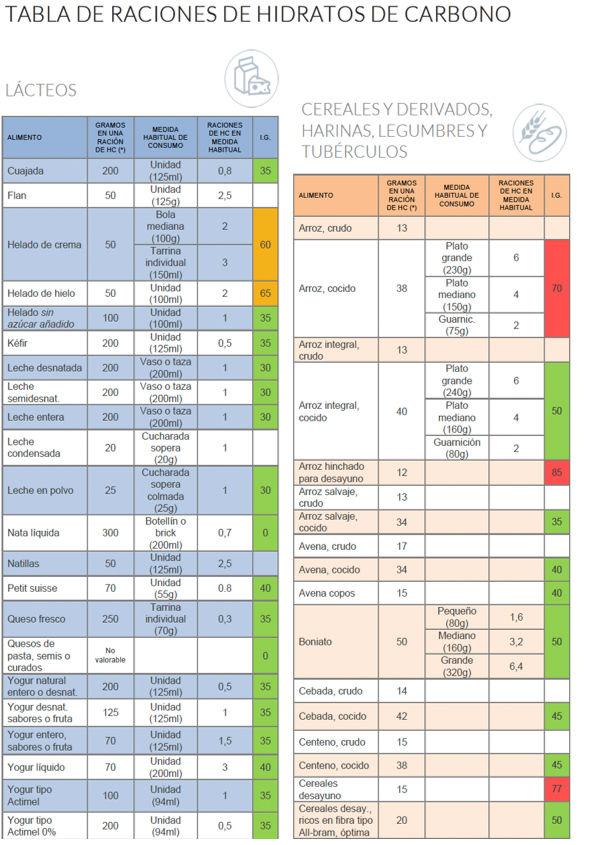
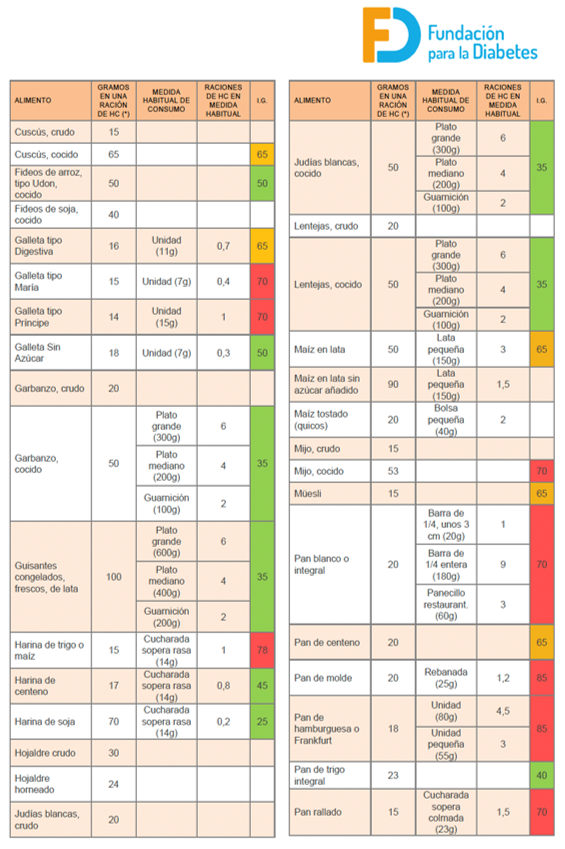
En la elaboración de la dieta por raciones, esta debe de ser equilibrada: 55% HC, 15% proteínas y 30% grasas. Esta se repartirá en 5 comida sal día: desayuno, media mañana, comida, merienda y cena. A continuación, ponemos un ejemplo del cálculo de una dieta por raciones en un paciente de 10 años.

BIBLIOGRAFÍA
- Almaguer YC, Pupo AS, Criollo LMT. Atención al paciente politraumatizado pediátrico. 2021.
- Anatomy of the Endocrine System in Children. Available at: https://www.stanfordchildrens.org/es/topic/default?id=anatomy-of-the-endocrine-system-in-children-90-P05044. Accessed Jun 27, 2024.
- Arroyo Díez FJ. Lo que debes saber sobre la diabetes en la edad pediátrica (4a. 2019).
- Barrios Castellano, R. Diabetes tipo 1 en la edad pediátrica. Lo que se necesita saber para la autogestión de la diabetes (2021).
- Benito Bernal AI, Vila de Frutos R. Neuroblastoma y tumores relacionados. Pediatría integral 2021;25(7):340.e1–340.e16.
- Cañete Nieto A, Pardo Romaguera E, Alfonso Comos P, Valero Poveda S, Porta Cebolla S, Valderrama Zurián JC, et al. Cáncer infantil en España. Estadísticas 1980-2023.
Registro Español de Tumores Infantiles (RETI-SEHOP). Universitat de València 2024. - Carreras E. Prevención y tratamiento de la enfermedad venooclusiva hepática. Gastroenterología y Hepatología 2011;34(9):635–640.
- Cebrián Muíños C. Criptorquidia y patología testículo-escrotal en la edad pediátrica. Pediatría integral 2019;23(6):271–282.
- Cid JL. Manual de cuidados intensivos pediátricos. : Publimed; 2013.
- Corral Sánchez MD, Tarabini-Castellani Ciordia BM. Tumor de Wilms y otros tumores renales. Pediatría integral 2021;25(7):341–347.
- Drake RL, Vogl AW, Mitchell AM. Gray. Anatomía para estudiantes. : Elsevier Health Sciences; 2020.
- Díez YB. Manejo del paciente politraumatizado. 2020.
- Fernández-Delgado R. La oncología pediátrica: pasado, presente y futuro. Anales de Pediatría 2016;85(2):59–60.
- Fernández-Plaza S, Reques Llorente B. Bases del tratamiento del cáncer en Pediatría: principios de la terapia multimodal. Pediatría integral 2016;20(7):465–474.
- García-Salido A, La Calle GH, González AS. Revisión narrativa sobre humanización en cuidados intensivos pediátricos: ¿dónde estamos? Medicina Intensiva 2019;43(5):290–298.
- Garreta Aperte ME. Técnicas y procedimientos de Enfermería. 2018.
- Guerrero-Fernández J, Sánchez AJC, Bonis ACB, Suso JM, Domínguez JR. Manual de diagnóstico y terapéutica en Pediatría. ; 2018.
- Herramienta online para la consulta y diseño de Planes de Cuidados de Enfermería. NNNConsult. Elsevier. 2015.
- Hockenberry MJ, Rodgers CC. Wong. Enfermería Pediátrica. : Elsevier; 2019.
- Hospital Universitario Virgen del Rocío. Manual de atención inicial al paciente pediátrico con traumatismo grave.
- Herramienta online para la consulta y diseño de Planes de Cuidados de Enfermería. NNNConsult. Elsevier. 2015; Available at: https://www-nnnconsult-com.bvsspa.idm.oclc.org/nanda.
- Iniciativa mundial para el desarrollo de registros de cáncer. TNM Esencial Guía del usuario. International Agency for Research Cancer. World Health Organization 2022.
- López Laso E, Mateos González ME. Tumores cerebrales infantiles, semiología neurológica y diagnóstico. Protoc diagn ter pediatr 2022;1:151–158.
- López Fernández E, Oviedo Melgares L, Ordoñez Sáez O, Belda Hofheinz S, Ramos Casado MV. Viabilidad y aceptación de los diarios de la UCI adaptados al paciente pediátrico, ¿una nueva herramienta contra el síndrome poscuidados intensivos familiar? Anales de Pediatría 2023;98(4):308-310.
- Macías Franco S, Rozas Reyes P. Patología congénita ocular. Pediatría integral 2018;22(1):6–15.
- Martínez Campos L, Pérez-Albert P, Ferres Ramis L, Rincón-López EM, Mendoza-Palomar N, Soler-Palacin P, et al. Documento de consenso de manejo de neutropenia febril en el paciente pediátrico oncohematológico de la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Hematología y Oncología Pediátrica (SEHOP). An Pediatr (Barc) 2023;98(6):446–459.
- Márquez-Díaz RR. Impacto de una intervención educativa sobre conocimientos del síndrome post-UCI pediátrico en cuidadores de niños hospitalizados. Proyecto de investigación. Nure Investigación 2023;20(124):1-8.
- Mendoza Sánchez MC, Riesco Riesco S, González Prieto A. Urgencias oncológicas en Pediatría. Pediatría integral 2019;23(2):65–80.
- Mezquita Romero L, Molinos Quintana A, Pérez Hurtado JM. Trombosis en la edad infantil. Manuales Clínicos 2022.
- Ministerio de Sanidad. Cuidados Paliativos Pediátricos en el Sistema Nacional de Salud: Criterios de Atención. 2014.
- Ministerio de Sanidad. Guía de Práctica Clínica sobre Cuidados Paliativos. 2008.
- Pérez Llarena G, Santos Ibáñez N. Punción port-a-cath. Sociedad Española de Urgencias de Pediatría (SEUP) 2021:1–8.
- Romo Muñoz MI, Núñez Cerezo V, Dore Reyes M, Vilanova Sánchez A, González-Peramato P, López Pereira P, et al. Tumores testiculares en la edad pediátrica: indicaciones de la cirugía conservadora. An Pediatr (Barc) 2018;88(5):253–258.
- Sastre Urgellés A, Rubio Aparicio P. Tumores óseos. Rabdomiosarcomas. Pediatría integral 2021;25(7):348–356.
- Suárez E, Serrano A. Atención inicial al traumatismo pediátrico. 2013;11(1):11-22.
- Tang M, Xu M, Su S, Huang X, Zhang S. Post-Intensive Care Syndrome in Children: A Concept Analysis. J Pediatr Nurs 2021;61:417-423.
- Traube C. Beware the Aftermath: Delirium and Post-Intensive Care Syndrome in Critically Ill Children. Pediatr Crit Care Med 2022;23(2):144-146.
- Toobe M. Síndrome post cuidados intensivos en pediatría. Rev Fac Cien Med Univ Nac Cordoba 2021;78(4):408-414.
- Vázquez Gómez F, Carceller Ortega E, Lassaletta Atienza A. Tumores cerebrales en niños. Pediatría integral 2021;25(7):357–366.
- Vázquez Rueda F, Murcia Pascual FJ, Siu Uribe A, Ortega Salas RM, Escassi Gil A, Garrido Pérez JI, et al. Análisis de los tumores sólidos ováricos pediátricos en nuestra población. An Pediatr (Barc) 2020;92(2):88–93.
- Wassner AJ. Thyroid nodules and cancer in children. UpToDate 2022.
- Wechsler DS. Overview of common presenting signs and symptoms of childhood cancer. UpToDate 2023.
