Se refiere a cualquier método o procedimiento utilizado para obtener acceso a la circulación sanguínea del paciente con el propósito de administrar medicación, fluidos, hemoderivados o nutrición parenteral; realizar monitorización hemodinámica invasiva; o la extracción de muestras de sangre.
Estos accesos pueden ser de diferentes tipos y se seleccionarán en función de las necesidades clínicas del paciente, la duración del tratamiento, la disponibilidad vascular o la urgencia de su obtención.
2.1 ACCESO VASCULAR PERIFÉRICO
- Catéter venoso de mariposa o palomilla: usadas para la extracción de sangre, tratamiento subcutáneo(SC) continuo o intermitente, o administración de bolos puntuales.

Palomilla metálica. Palomilla con catéter y guía metálica extraíble.
Ilustración 7:Tipos de catéter venoso de palomilla. Fuente:Collage de elaboración propia a través de imágenes de varios autores.
En caso de utilizarse para terapia IV, se recomienda evitar aquellas palomitas de aguja de acero puesto que aumenta el riesgo de lesiones intravasculares de origen mecánico y mayor número de extravasaciones; y se recomendará el uso de dispositivos de última generación de poliuretano con guía metálica extraíble.
- Catéter venoso corto de cánula y aguja (también conocido como vía venosa periférica o VPP): consiste en la inserción de una cánula de corta longitud en una vena periférica como pueden ser las venas de las manos, brazos, piernas o cuero cabelludo, del mayor calibre posible.
Es el método menos invasivo y de primera elección.

Los flujos pueden variar ligeramente según el fabricante
Ilustración 8: Vía venosa periférica. Fuente: Elaboración propia del autor.
Cuenta con la ventaja de ser una técnica muy habitual y accesible, permitiendo terapia IV con pocas complicaciones (normalmente de tipo local en la vena de inserción, siendo más probables cuanto mayor sea la capacidad irritativa de la solución administrada).
- Catéter venoso corto de longitud media (línea media Midline o Mini-Midline): se trata de un catéter de mayor longitud que los anteriores (Midline [20-25 cm] – Mini-Midline [8-10 cm]), cuyo extremo distal quedará alojado generalmente a nivel de la vena axilar e incluso subclavia, siendo usados para tratamientos de duración media.
- Debido a su colocación en vasos de mayor caudal y calibre (vena cefálica o basílica profunda), se asocian con tasas inferiores de flebitis con respecto de las VVP; y tasas inferiores de infección con respecto a los catéteres centrales.
- Permite la administración de soluciones de osmolaridad menor a 800-850 mOsm/L. Sin embargo, por su colocación más dificultosa, con técnica estériltip o Seldinger o Seldinger Modificada, normalmente ecoguiadas, hace que no sea un procedimiento de elección para situaciones de urgencia o emergencia pero sí para el tratamiento del paciente a medio plazo.
- Técnica Seldinger:
- Se pinchará la vena conaguja (1).
- Introducción de guía (1) (se debe tener control de la guía en todo momento de la técnica para evitar su
introducción en el torrente sanguíneo).
- Retirada de la aguja, manteniendo la guía.
- Realización de corte con bisturí (2) para ensanchar el orificio, con precaución de no dañar la guía.
- Introducción de dilatador a través de la guía (3) (4).
- Retirada del introductor, manteniendo la guía.
- Introducción del catéter através de la guía (5).
- Retirada de la guía.
- Fijación.

Ilustración 9. Técnica Seldinger.
Fuente: https://campusvygon.com/es/
- Técnica Seldinger Modificada (o Micro-Seldinger):
- Se pinchará la vena con aguja (1).
- Introducción de la guía (1).
- Retirada de la aguja, manteniendo la guía.
- Realización de corte con bisturí para ensanchar el orificio con precaución de no dañar la guía.
- Introducción del dilatador-introductor a través de la guía (2).
- Retirada de la guía y del dilatador interno (3).
- Introducción del catéter a través del introductor (4).
- Retirada del introductor mediante ruptura por su zona media y “pelado”, quedando el catéter insertado (5).
- Fijación.

Ilustración10.Técnica Seldinger modificada.
Fuente:https://campusvygon.com/es/
2.2 ACCESO VENOSO CENTRAL DE INSERCIÓN PERIFÉRICA (PICC)
Catéter de mayor longitud que los anteriores, insertado a través de una vena periférica del brazo (cefálica, braquiales o basílica) quedando alojado su extremo distal en la unión cavo-auricular.
Indicado en pacientes que requieren tratamiento IV a largo plazo (superior a 30 días) o que requerirán la administración de alimentación parenteral o electrolítos con osmolaridad mayor de 800 – 850 mOsm/L y/o fármacos irritantes/vesicantes con pH menor de 5 o superior a 9.
Para su inserción, se realizará generalmente con técnica Micro-Seldinger de forma estéril, con punción ecoguiada.
Se deberá elegir la longitud del catéter, cortándolo con bisturí en ángulo de 90º. Para calcular esta distancia, se tomará como referencia el punto elegido para la punción mediante la exploración ecográfica. Mediremos hasta la línea media infraclavicular y desde este punto hasta el tercer espacio intercostal paraesternal derecho.
La elección del calibre del catéter (medida en French [F]) se realizará en función del calibre de la vena elegida, teniendo en cuenta que el catéter no debe ocluir más de un tercio del diámetro del vaso (se permite ocluir la mitad del diámetro del vaso en niños). De forma general, elegiremos los siguientes calibres en función de la edad y el peso:

Tras su colocación, será necesario comprobar la correcta ubicación de su punta en la unión entre vena cava superior y aurícula derecha mediante radiología de tórax o utilización de método ECG.
- Comprobación mediante método ECG:
- Se colocarán cables de monitorización ECG de la misma manera que para la monitorización básica del paciente, pero con la modificación de colocar la pinza del electrodo de miembro superior izquierdo unida al cable que se conectará a la conexión del catéter PICC.
- Se tomará como referencia la onda P para determinar la correcta colocación.
- Cuando la onda P se vuelve bifásica, esdecir, cuenta con una parte negativa, significará que el catéter ha entrado en la aurícula.
- A medida que la punta del catéter se acerca al nodo sinusal, la onda P aumenta de tamaño.
- Retraerelcatéterydejarloalojadoenla posición en que la onda P es máxima.

Ilustración11.Comprobación de PICC mediante método ECG.
Fuente: https://campusvygon.com/es/
- Mantenimiento del PICC (también aplicable a catéteres de línea media):
- Curas cada 7 – 10 días (o cuando se encuentre sucio, despegado o haya presencia de sangre).
- Limpieza y desinfección del punto de inserción y zona colindante de forma estéril.
- Cambio de conectores.
- Lavado con SSF con técnica Push-Stop (lavado a pulsos intermitentes del catéter con el objetivo de evitar el reflujo de sangre y crear una turbulencia que arrastre la mayor cantidad posible de restos de fármacos o de la solución perfundida, así como una mayor reducción del biofilm).
- Clampaje con técnica de presión positiva.
2.3 ACCESOS VENOSOS CENTRALES
Acceso a la circulación del paciente a través de la inserción de un catéter en una vena de mayor calibre y cercanía al corazón (vena subclavia, vena femoral o vena yugular), quedando alojado su extremo distal en la zona de unión cavo-auricular al igual que en el caso anterior.
La canalización de este tipo de accesos, será realizada por el personal médico, sin embargo el procedimiento debe ser conocido por enfermería puesto que van a ser colaboradores necesarios para su colocación.
Para ello, mediante procedimiento estéril, se puncionará la vena elegida (de manera ecoguiada o no) y se desarrollará la colocación del catéter mediante técnica Seldinger de igual manera que se ha explicado anteriormente en el PICC, procediendo tras su colocación a fijar el catéter mediante sutura a la piel.
En cuanto a los cuidados de mantenimiento, se seguirán las mismas recomendaciones dadas para los PICC.

Ilustración 12. Colocación de vía venosa central.
Fuente: https://www.consalud.es/salud35/nacional/laboratorios-rovi-impulsa-las-jornadas-de-debate-en-terapia-intravenosa_11350_102.html
Por otro lado, este tipo de catéteres suelen contar con múltiples luces, lo que va a dar lugar a la posibilidad de administrar múltiples soluciones a su través y los hacen idóneos para el paciente crítico, sin embargo, ante la necesidad de administrar dos perfusiones o medicamentos por una misma luz, habrá que comprobar su compatibilidad.
En el uso de las luces, serecomendará:
- Luz distal: se trata de la de mayor calibre. Se utilizará principalmente para la infusión de soluciones o hemoderivados a altos flujos o de alta densidad como la albúmina.
Por otro lado, por ser la luz más cercana al corazón se empleará para la monitorización de la presión venosa central (PVC).
- Luz proximal: se empleará para la administración de sedoanalgesia o aminas vasoactivas (como adrenalina o noradrenalina).
Preferentemente se ha guardado esta luz para la administración continua de las drogas vasoactivas, debido a la posibilidad de efecto “bolus” e inestabilización del paciente si son administradas por las luces mediales o distal.
Este efecto no está demostrado debido a que al tratarse de la canalización de venas de gran calibre, la medicación administrada se diluye inmediatamente en el flujo sanguíneo desapareciendo prácticamente este efecto (aunque en muchos protocolos se sigue recomendando por precaución).
También podría utilizarse para la obtención de muestras de sangre (la sangre por ella obtenida no se ve afectada por las perfusiones infundidas por las otras luces). - Luces mediales (una o varias): se trata de vías con menor calibre empleadas para la administración de sedoanalgesia, mediación puntual u otras perfusiones.
En muchas ocasiones, se reserva esta luz para la administración de la nutrición parenteral (NP), sin embargo, no existe consenso, puesto que algunos trabajos recomiendan su administración por la luz distal debido al menor riesgo de coagulación que presenta. No obstante, hay que tener en cuenta que la NP necesitará una línea exclusiva para su administración y que requiera la menor cantidad de manipulaciones posibles (por el alto riesgo de colonización bacteriana asociada a su base lipídica).
2.4 ACCESOS VASCULARES UMBILICALES
Canalización de los vasos del cordón umbilical como vía de acceso centralal torrente vascular del recién nacido (RN).
Esta técnica será llevada a cabo por el médico neonatólogo con la ayuda de enfermería, en aquellos bebés prematuros o RN en estado crítico que precisarán de un acceso para la administración de medicación o fluidos (en el caso de la vena umbilical); o para la monitorización arterial (en el caso de las arterias umbilicales).
Técnica para su colocación:
- Colocación del RN en posición supina, asegurando inmovilizaciónde brazos y piernas.
- Utilización de fuente de calor radiante durante la realización de esta técnica con el fin de evitar la producción de hipotermia.
- Monitorización continua de la oxigenación..
- Técnicaestéril.
- Cálculo de la longitud del catéter a insertar:
- Método Shukla: basada en el peso del RN:
- Catéter arterial:
Peso menor de 1.500 g:
Posición baja: Cm a introducir = Peso en Kg + 7. Posición alta: Cm a introducir=(4xPeso en Kg)+7.
Peso mayor de 1.500 g:
Cm a introducir= (3 x Peso en Kg) + 9.
- Catéter venoso:
Cm a introducir =(1,5 x Peso en Kg)+5,5.
- Técnica Dunn: basada en la medición de la distancia en línea recta entre el ombligo y el hombro del RN.

Ilustración 13. Anatomía del corón umbilical.
Fuente: https://www.reproduccionasistida.org/placenta-cordon- umbilical/anatomia-cordon-umbilical/

Ilustración 14.Cálculo de la longitud de los catéteres de acceso vascular mediante técnica Dunn.
Fuente:https://campusvygon.com/es/
- Preparación de material.
- Preparación del cordón umbilical y piel circundante con solución antiséptica (clorhexidina).
- Purgar el catéter con suero salino heparinizado.
- Colocar ligadura umbilical alrededor de la base del muñón umbilical y cortar el exceso del cordón con tijeras o bisturí, dejando 1 cm aproximadamente.
- Identificar los tres vasos umbilicales. La vena, será el vaso central de mayor tamaño y pared delgada; mientras que las arterias serán los dos vasos de menor tamaño y con paredes más gruesas y musculares.
- En el caso arterial, abrir el vaso a canalizar introduciendo suavemente un dilatador y girarlo varias veces mientras el cordón se mantiene recto y estable.
- En la cateterización venosa, no se necesitará dilatador, sin embargo, habrá que eliminar los coágulos que puedan haberse formado antes de introducir el catéter por el orificio.
- Introducción del catéter centímetro a centímetro ayudados con la pinza hasta llegar a la profundidad apropiada.
- Aspiración e irrigación para comprobar el correcto reflujo de sangre y con statar que no se producen cambios de coloración en los miembros inferiores y región glútea del RN.
- Comprobación de la localización de la punta mediante radiografía o ecografía.
- Fijación del catéter empleando tela adhesiva en forma de puente sujetando el catéter o mediante tela adhesiva suturada al cordón umbilical.

Ilustración15. Canalización acceso vascular y arterial umbilical.
Fuente: https://campusvygon.com/es/

Ilustración16.Fijación catéteres de acceso umbilical.
Fuente: https://campusvygon.com/es/
El catéter umbilical, venoso o arterial, deberá permanecer el mínimo tiempo necesario con el objetivo de evitar la aparición de complicaciones. El tiempo máximo recomendado de permanencia, será de 5 días en el caso arterial y de 14 días en el venoso.
Cuidados:
- Manejo aséptico del catéter.
- Realizar la primera cura tras las 24 h de su introducción.
- Cura en cada turno, comprobando su correcta fijación y colocación.
- Cura del muñón umbilical diaria.
- Observación de la coloración y temperatura de las extremidades inferiores (catéter arterial).
- Mantener una perfusión continua de líquidos para evitar su obstrucción mediante solución heparinizada con una concentración de 0,25 – 1 U/mL de heparina (no se recomienda la heparinización en bolo).
- Limpieza del catéter antes y después de la administración de cualquier solución para prevenir su obstrucción.
2.5 ACCESOS ARTERIALES
Procedimiento utilizado para la obtención de acceso a la circulación arterial con el propósitode conseguiruna monitorización de la TA deforma continua, ola estimación del gasto cardiaco y otros parámetros hemodinámicos; realización frecuente de mediciones de gases sanguíneos; o la obtención de muestras de sangre para pruebas diagnósticas.
En este tipo de accesos, no se administrarán medicaciones (salvo SSF o suero heparinizado para evitar la formación de coágulos) puesto que pueden resultar irritantes, dolorosos e inclusos originar disfunción motora, gangrena, síndrome compartimental o amputación.
Podemos distinguir entre:
- Acceso arterial periférico: se realizará a través de la arteria radial, braquial, humeral o pedia (técnica generalmente realizada por enfermería).

Ilustración 17. Localización anatómica arteria radial, braquial y pedia.
Fuente: Javier Sáez Hurtado. Anatomía Humana: Sistema Locomotor. Paradigma. https://paradigmia.com/curso/locomotor/
En el caso de la canalización radial, se recomienda la realización del Test de Allen para valorar la permeabilidad arterial y la circulación colateral.
Desarrollo del Test de Allen:
- Comprimir simultáneamente las arterias radial y cubital (1).
- Pedir al paciente que abra y cierre la mano repetidamente unas 10 – 15 veces mientras se mantiene la oclusión de ambas arterias (1) (2). Al abrir la mano, se observará la palidez de palma y dedos.
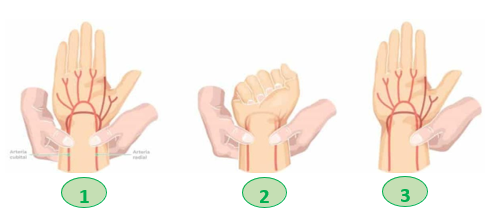
Ilustración 18. Testde Allen.
Fuente:https://campusvygon.com/es/
- Liberar la presión de la arteria cubital, manteniendo la presión sobre la arteria radial (3).
- Observar cuanto tiempo tarda la mano en recuperar su color.
- Interpretación:
- Si tiempo < 5 segundos, resultado negativo y se considerará que está presente una buena circulación, permitiendo una canalización de la arteria radial de forma segura.
- Si el tiempo se encuentra entre 5 y 9 segundos, el resultado será dudoso y serán necesarias pruebas complementarias.
- Si el tiempo es > 10 segundos, el resultado será positivo, estando contraindicada la canalización.
- Acceso arterial central: inserción del catéter en una arteria de mayor calibre como la arteria femoral o la umbilical en el caso de los RN (técnica generalmente realizada por el personal médico).

Ilustración 19. Localización anatómica arteria femoral y arterias umbilicales.
Fuete 1: Javier Sáez Hurtado. Anatomía Humana: Sistema Locomotor. Paradigma. https://paradigmia.com/curso/locomotor/; Fuente 2: https://campusvygon.com/es/

Ilustración 20. Canalización de arteria pedia.
Fuente: elaboración propia del autor.
Materiales (canalización periférica y central ,excepto umbilical):
- Material de barrera para protección individual.
- Kit de canalización arterial.
- Anestésicos locales.
- Suero heparinizado con presurizador para generar un flujo continuo que impida la obstrucción del catéter.
- Sistema para medición de TA invasiva.
- Transductor depresión.
- Software de TA invasiva.
- Seda.
- Apósitos de fijación.
Técnica (excepto para la canalización umbilical ,ya explicada anteriormente):
- Técnica estéril.
- Colocar al paciente en decúbito supino o Semifowler.
- Preparación de la piel con desinfectantes (clorhexidina).
- Localizar la arteria a puncionar, bien mediante ecografía o por palpación del pulso.
- Puncionar la arteria en sentido dista-proximal (es decir, en contra del flujo arterial), colocando el bisel de la aguja hacia arriba. En función de la arteria a puncionar y características del paciente se elegirá un ángulo de inclinación de entre los 30º y los 90º.
- Avanzar la aguja hasta que aparezca sangre enel reservorio. Deberáseruna sangre roja brillante, con salida pulsátil.
- Mantener la aguja en el lugar indicado e introducir a su través la guía.
- Retirar aguja y mantener la guía (siempre debe estar sujeta).
- Introducción del catéter a través de la guía.
- Retirarla guía.
- Conectar sistema de transducción.
- Fijar el catéter con seda a la piel del paciente y colocar apósito estéril sobre ello.
2.6 ACCESO INTRAÓSEO (IO)
Método que implica el acceso a la circulación del paciente a través de una aguja especial insertada en la cavidad medular de un hueso largo (generalmente tibia o húmero).
En el caso de los paciente lactantes y pediátricos es una buena solución para situaciones de emergencia en las que no es posible el acceso periférico (por ausencia de capital venoso o colapso circulatorio) en un tiempo razonable (90 segundos en caso de emergencia vital); y el acceso venoso central no es viable por su necesidad inmediata.
Sin embargo, en neonatos, la canalización IO ocupa un lugar menos destacado puesto que la prioridad en ellos, será la canalización umbilical en caso de emergencia, siendo la IO reservada para situaciones en las que no que no se consigue la umbilical.
Limitaciones de la técnica:
- Solo debe usarse en situaciones de urgencia vital y por tiempo limitado.
- Si el paciente está consciente, es necesario utilizar analgesia.
- Limitación en la cantidad de volumen a administrar y compatibilidad entre fármacos por disponer de una única via.
- No se puede canalizar si hay sospecha de hueso fracturado, celulitis, osteomielitis, traumatismo abdominal grave (precisaría canalización en miembros superiores), antecedentes de prótesis osteo-articulares o presencia de quemaduras o necrosis profundas que puedan afectar al hueso.
- En caso de técnica fallida, no se puede puncionar nuevamente el hueso afectado.
- Riesgo de sepsis en uso durante un tiempo excesivo.
Elección del lugar de punción:
Según los documentos del Grupo Español de RCP Pediátrica y Neonatal, se recomienda:
- RN y niños menores de 6 años: TIBIA PROXIMAL (el punto de punción se sitúa 1 – 2cm por debajo del punto medio de la línea imaginaria que une la tuberosidad anterior tibial con el borde interno de la misma).

Ilustración 21. Localizació nanatómica canalización intraósea tibial proximal.
Fuente:SAMUR- Protección Civil. Manual de procedimientos asistenciales. https://www.madrid.es/ficheros/SAMUR/data/604_05b.htm
- Niños mayores de 6 años: TIBIA DISTAL (2 – 3 cm por encima del maléolo tibial interno). Sin embargo con la aparición de dispositivos que permiten atravesar corticales más duras, cada vez se utiliza más la punción Tibial Proximal independientemente de la edad por poseer un espacio medular más amplio y encontrarse más próxima a la piel.

Ilustración 22. Localización anatómica canalización intraósea tibial distal.
Fuente:SAMUR- Protección Civil. Manual de procedimientos asistenciales. https://www.madrid.es/ficheros/SAMUR/data/604_05b.htm
- Alternativas:
- Fémur: 2–3 cm por encima del cóndilo lateral.
Ilustración 23. Localización anatómica canalización intraósea a nivel femoral.
Fuente: SAMUR-Protección Civil. Manual de procedimientos asistenciales. https://www.madrid.es/ficheros/SAMUR/data/604_05b.htm
- Húmero: cara anterior de la cabeza humeral (de elección en adolescentes y adultos).
Localización: Colocar brazo del paciente en aducción,rotando internamente el húmero 90º (el codo puede o no estar flexionado).

Colocar la palma de la mano sobre la prominencia de la cabeza humeral, notando una prominencia enforma de bola. 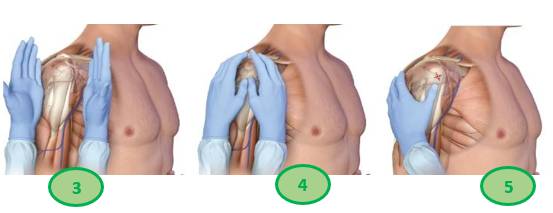
Colocar ambas manos delimitando la cabeza humeral. Una mano se situará sobre la axila y la otra paralela al húmero.
Colocar los pulgares juntos sobre el brazo identificando el cuello quirúrgico del húmero (zona de transición entre epífisis y diáfisis). Aparecerá un resalte siguiendo la línea vertical entre troquiter y troquín.
Palpar el punto de inserción en el área más prominente de la cabeza del húmero, 1–2 cm sobre el cuello quirúrgico

Ilustración 24. Localización anatómica canalización intraósea humeral.
Fuente:SAMUR-Protección Civil. Manual de procedimientos asistenciales. https://www.madrid.es/ficheros/SAMUR/data/604_05b.htm
Introducir la aguja en ángulo de 45º sobre el plano horizontal en sentido caudal para evitar dañar la epífisis de crecimiento.
- Cresta iliaca: punción en la parte anterior de la espina iliaca.
- Esternón: lugar alternativo para niños mayores de 3 años y siempre que no se encuentre en PCR o haya posibilidad de que se produzca.
- Radio distal: en cara opuesta a la arteria radial.
- Cubito distal.
Dispositivos:

Ilustración 25. Dispositivos de canalización intraósea.
Fuente: José Luis Gómez Urquiza. Principios sobre la vía intraósea. 2022. SalusPlay. https://www.salusone.app/cuida/infografias-cientificas
Técnica:
Dependerá del dispositivo empleado:
- Una vez seleccionado el punto de punción, colocar la zona sobre una superficie lisa y dura.
- Aplicar antiséptico en el lugar de punción.
- Se recomienda aplicar anestesia local en caso de paciente consciente.
- Colocar el dispositivo/aguja de forma perpendicular al punto de punción.
- En los dispositivos con aguja visible, ejercer presión para atravesar la piel y tejidos blandos hasta notar una resistencia que significará el contacto con el hueso.
- En los casos de aguja COOK IO, FAST IO, ILLINOSIS STERNAL o JAMSHIDI IO, se sujetará el sistema con la mano dominante, situando la empuñadura en la eminencia tenar al mismo tiempo que con los dedos índice y pulgar se sujeta la aguja, como si de un lápiz se tratara, a una distancia de 0,5 cm de la piel para ejercer de freno.
Ejercer presión al mismo tiempo que se efectúan movimientos rotatorios para perforar la cortical.
Cuando se note una disminución de la resistencias, se parará la presión puesto que se habrá atravesado la cortical y se encontrará en la cavidad medular.

Ilustración 26. Aguja COOK IO.
Fuente: Elisabeth Gómez Santos. En procedimiento de canalización de aguja intraósea dispositivo COOK®. 2013. Universidad de Alicante. https://masteremergenciasua.com/procedimiento-de-canalizacion-de-aguja-intraosea-dispositivo-cook/
- Con el dispositivo BIG (Bone Injection Gun), se seleccionará el color en función del paciente (Rojo – Pediátrico y Azul – Adulto, aunque los colores pueden variar en función del fabricante) y se preseleccionará la profundidad a introducir de la aguja (roscando o desenroscando la parte móvil del cilintro).
Se colocará la pistola sujetada con la mano dominante situando la empuñadura en la eminencia tenar y colocando los dedos índice y medio por debajo de las pestañas del cuerpo, de forma que la flecha se dirija hacia el punto de punción.
Retirar el pasador de seguridad.
Colocar perpendicular al lugar de inserción y disparar manteniendo los dedos índice y medio bajo el soporte y presionando el disparador que se encuentra en la eminencia tenar.

Ilustración 27. Dispositivo BIG de canalización intraósea.
Fuente: https://navendi.com/otros-elementos-sanitarios/11961-pistola-para-inyeccion-intraosea.html
- Taladro EZ-IO: dispositivo que se asemeja a algunas herramientas utilizadas en cirugía ortopédica y traumatológica y que insertará un catéter metálico en la médula ósea mediante rotación del dispositivo y la presión ejercida por el interviniente.
Para su colocación, montaremos el catéter con el mandril interno en el taladro y lo dirigiremos hacia el punto escogido de punción, atravesando todas las capas de tejido blando hasta llegar al periostio.

Ilustración 28. Taladro EZ-IO.
Fuente: https://www.mevesur.com/kit-especiales-acceso-vascular/6183-pistola-sistema-de-acceso-vascular-intraoseo-arrow-ezio.html
Accionar el taladro presionando con firmeza hasta notar una pérdida repentina de resistencia.
Extraer el taladro y el mandril de la aguja, dejando el catéter.
- Conectar una jeringa con SSF al catéter y aspirar para confirmar su correcta posición y lavar su luz a continuación (abrirá el espacio intraóseo y mejorará el flujo).
Este lavado puede causar gran dolor en paciente consciente puesto que generará la ruptura de las trabéculas del hueso. Algunos autores proponen la administración de Lidocaina al 2% lentamente previo al lavado para disminuir el dolor asociado:
- En niños, se recomienda una dosis de 0,5 mg/Kg de Lidocaina 2%, con un máximo de 40 mg, administrado en 2 min. aproximadamente y esperar 1 minuto para que haga efecto. A continuación lavar con un bolo de 2 – 5 mL de SSF en 5 segundos.
- En adolescentes y adultos con pesos mayores de 80 Kg, se recomienda la administración de 40 mg de Lidocaina al 2%, administrada lentamente, esperar 1 min y realizar el lavado con 5 – 10 mL de SSF en 5 segundos. - Fijar la aguja para evitar su salida o desplazamiento, evitando tapar el punto de punción.
Puede emplearse una pinza quirúrgica tipo Kocher o mosquito, pinzando la base de la aguja siguiendo el eje longitudinal del miembro y sujetada al mismo mediante esparadrapo; fijar con el pasador de seguridad de las pistolas BIG; o con apósitos especiales de fijación en el caso del taladro.
Ilustración 29. Fijación de aguja intraósea.
Fuente: Collage de elaboración propia a través de imágenes de varios autores.
Cuidados:
- Manejo con técnica estéril siempre.
- No ocluir la zona de punción con apósitos (salvo los específicamente diseñados para ello) para evitar la maceración de la zona.
- Evitar la manipulación directa de la aguja. Se instalará una llave de tres pasos o alargadera a la aguja y será por ella por la que se administren los fármacos o líquidos.
- Comprobar con frecuencia su permeabilidad. Si se sospecha obstrucción lavar con SSF; si se sospecha choque contra la cortical posterior, se retirará unos milímetros y se comprobará nuevamente su permeabilidad.
- Observar frecuentemente el punto de inserción en busca de signos de extravasación.
- Valoración de color, tamaño, temperatura y pulsos distales de la extremidad puncionada con el objetivo de prevenir la aparición de síndromes compartimentales.
- Tener en cuenta que debido a la colocación de un catéter metálico, está contraindicada la realización de Resonancia Magnética Nuclear (RMN).
- Permite la administración de toda medicación que se administre por vía IV, excepto la nutrición parenteral.
Retirada:
Para su retirada, colocar una jeringa Luer-Lock roscada en la aguja y siguiendo el mismo sentido de la rosca, tirar hacia atrás firmemente de forma perpendicular al lugar de inserción.

Ilustración 30. Retirada vía intraósea.
Fuente: Ramón Reyes. MED-TAC International Corp. 2022. https://tactical-medicine.com/blogs/news/rapid-intraosseous-access-ez-io-dispositivo-para-acceso-rapido-intraoseo-ez-io
BIBLIOGRAFÍA
- Cuñarro A , Alcorcón A. Monitorización en pediatría. Neonatos.org-Hospital Universitario Fundación Alcorcón. 2008.
- Bonillo Caballero M del C, Rodríguez Pérez N, Bonillo Caballero M,Yagüe Perandrés A, Tomás Cantos P, Orellana Muñoz L, et al. Tema 3. monitorización cardiovascular. SalusPlay. Disponible en: https://www.salusplay.com/apuntes/cuidados-intensivos-uci/tema-3-monitorizacion-cardiovascular
- Enfermera en UCI y Anestesia V. Parámetros vitales en un monitor de UCI. Cuidado-intensivo.com. 2020. Disponible en: http://cuidado-intensivo.com/parametros-vitales-en-un-monitor-de-uci/
- Mencía Bartolomé S, López-Herce Cid J, Lamas Ferreiro A, Borrego Domínguez R, Sancho Pérez L, Carrillo Álvarez A. Aplicación del índice biespectral en la monitorización del niño enfermo crítico. Anales de Pediatría. 2005; 64 (1): 96– 99.Disponible en: https://www.analesdepediatria.org/es-aplicacion-del-indice-biespectral-monitorizacion-articulo-13083842
- Carrillo Álvarez A, López-Herce Cid J. Conceptos y prevención de la parada cardiorrespiratoria en niños. Anales de Pediatría.2006;65(2):140–6.Disponible en: https://www.analesdepediatria.org/es-conceptos-prevencion-parada-cardiorrespiratoria-ninos-articulo-13091483
- Perkins GD, Graesner JT, Semeraro F, Olasveengen T, Soar J, Lott C, et al. European Resuscitation Council Guidelines 2021: Resumen ejecutivo - Traducción oficial del consejo español de resucitación cardiopulmonar (CERCP) Consejo Español de Resucitación Cardiopulmonar - European Resucitation Council. 2021; Disponible en:https://erc.edu/about
- Fernández de Miguel S, Murga Herrera V. Carro de parada.Medicación y material de urgencias. Pediatr Integral. 2019; XXIII (2): 106.e1-106.e6.
- Rodríguez Álvarez D, del Rio García M.Reanimación cardiopulmonar básica y semiavanzada. Pediatr Integral. 2024; XXVIII (1): 58–64. Disponible en: https://www.pediatriaintegral.es/publicacion-2024-01/reanimacion-cardiopulmonar-basica-y-semiavanzada/
- Comité de Estándares de la Sociedad Española de Neonatología (SENEO). Protocolos de la SENEO 2023. Grupo Pacífico.Madrid:Sociedad Española de Neonatología; 2023. Disponible en: https://www.seneo.es/index.php/publicaciones/protocolos-de-la-seneo-2023
- Schlesinger SA. Reanimación cardiopulmonar (RCP) en lactantes y niños - Cuidadoscríticos-Manual MSD versión para profesionales.Merc&Co,Inc.2023; Disponible en:https://www.msdmanuals.com/es-es/professional/cuidados-cr%C3%ADticos/paro-card%C3%ADaco-y-reanimaci%C3%B3n-cardiopulmonar/reanimaci%C3%B3n-cardiopulmonar-rcp-en-lactantes-y-ni%C3%B1os
- Iriondo Sanz M, Burón Martínez E, Thió Lluch M, Maldonado J A, Salguero García E, Fernández JR, et al. Reanimación neonatal. Asociación Española de Pediatría (AEP) - Protocolos Diagnósticos Terapéuticos: Neonatología. 2008. 111–125. Disponible en: www.aeped.es/protocolos/
- Castellanos Ortega A, Rey Galán C, Carrillo Álvarez A, López-Herce Cid J, Delgado Domíguez MA. Reanimación cardiopulmonar avanzada en pediatría. Anales de Pediatría. 2006; 65 (4): 342–363. Disponible en: https://www.analesdepediatria.org/es-reanimacion-cardiopulmonar-avanzada-pediatria-articulo-13092491
- Dariya V, Moresco L, Bruschettini M, Brion LP. Cuffed versus uncuffed endotracheal tubes for neonates.Cochrane Database of Systematic Reviews. 2022; (1). Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013736.pub2/full
- AnestesiaR. Tubos endotraqueales pediátricos con o sinbalón: revisión de un metanálisis. Anestesiar.org. Disponible en: https://anestesiar.org/2016/tubos-endotraqueales-pediatricos-sin-balon-revision-metanalisis/
- De Orange FA, Lemos A, Figueiroa JN. Cuffed versus uncuffed endotracheal tubes for general anaesthesia in children aged eight years and under. Cochrane Database of Systematic Reviews. 2017 (11). Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011954.pub2/full
- Martínez Mejías A. Reanimación cardiopulmonar básica y avanzada pediátrica. AEP Protocolos. 2020; 1: 31–48. Disponible en:www.aeped.es/protocolos/
- Sánchez Perales F, Rubio Gribble B, Pérez-Lescure Picarzo J, Bueno Campaña M. Reanimación cardiopulmonar avanzada. AEPap ed Curso de actualización pediatría 2005. 2005; 141–57.
- Rodríguez Núñez A,Iglesias Vázquez JA. Desfibrilación semiautomática en niños. Anales de Pediatría. 2006; 65 (5): 478–480. Disponible en: https://www.analesdepediatria.org/es-desfibrilacion-semiautomatica-ninos-articulo-13094261
- RodríguezNúñez A, López-HerceCid J,Hermana Tezanos MT, Rey Galán C. Ética y reanimación cardiopulmonar pediátrica.Anales de Pediatría.2007; 66(1):45–50.Disponible en:https://www.analesdepediatria.org/es-etica-reanimacion-cardiopulmonar-pediatrica-articulo-13097359
- Campus Vygon. ¿Cómo colocar un catéter umbilical?: Protocolo de inserción y fijación. Campusvygon.com. 2020. Disponible en: https://campusvygon.com/es/protocolo-colocar-cateter-umbilical/
- Femora-Sergas.Procedimiento.Aspiración de secreciones vía respiratoria alta. Sergas. Disponible en: https://femora.sergas.gal/Via-respiratoria/Procedemento---Aspiraci%C3%B3n-VRA?idioma=es
- Banco de preguntas Preevid. A una persona con oxigenoterapia, ¿es necesario humidificar el oxígeno durante todo el tiempo?. Murciasalud.es. 2019. Disponible en: https://www.murciasalud.es/preevid/23308
- Hayes D,Wilson KC, Krivchenia K, Hawkins SMM, Balfour-Lynn IM, Goza lD, et al. Home oxygen therapy for children an official American Thoracic Society clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 2019; 199 (3): E5–23.
- Rodríguez J, Reyes M, Jorquera R.Oxigenoterapia en pediatría. Rev PedElec. 2017; 14.
- Pilar Orive FJ, López Fernández YM. Oxigenoterapia de alto flujo. Anales de Pediatría Continuada. 2014; 12 (1): 25–29. Disponible en: https://www.elsevier.es/es-revista-anales-pediatria-continuada-51-articulo-oxigenoterapia-alto-flujo-S1696281814701635
- Pírez C,Peluffo G,Giachetto G,Menchaca A,Pérez W, Machado K,et al.Cuidados de enfermería en pacientes con oxígeno de alto flujo y ventilación no invasiva. Archivos de Pediatría del Uruguay. 2020; 91: 48–51. Disponible en: http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S1688-12492020000700048&lng=es&nrm=iso&tlng=es
- Suarez-Sipmann F, Pérez Márquez M, González Arenas P. Nuevos modos de ventilación: NAVA. Med Intensiva. 2008; 32 (8): 398–403. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0210-56912008000800005
- Martínez de Azagra A, Casado Flores J, Jiménez García R. Ventilación mecánica en pediatría.¿Cómo y cuándo extubar?.Med.Intensiva.2003;27(10):673–675. Disponible en:https://www.medintensiva.org/es-ventilacion-mecanica-pediatria-como-cuando-articulo-13055982
- Hernández-López GD, Cerón-Juárez R, Escobar-Ortiz D, Graciano-Gaytán L, Gorordo-Delsol LA, Merinos-Sánchez G, et al. Retiro de la ventilación mecánica. Med Crit. 2017; 31 (4): 238–245. Disponible en:www.medigraphic.org.mx
- Miralles Rojano Á, Ramos Hidalgo J, Brioansó Llort M, Burló Arévalo N, Aguilar Mariné A, Español Guionnet M, et al. Cuidados de Enfermería en la retirada de ventilación mecánica. Revista Electrónica de Portales Medicos.com. 2017: 1–2. Disponible en: https://www.revista-portalesmedicos.com/revista-medica/cuidados-enfermeria-retirada-ventilacion-mecanica/2/
- Mariscal Flores M, Pindado Martínez M. Actualizaciones en la mascarilla laríngea para intubación Fastrach en los últimos 10 años. Anestesiar.org. 2010.
- Merck & Co. Manual Merck versión para profesionales. Vía aérea de mascara laríngea. Disponible en: https://www.merckmanuals.com/es-us/professional/multimedia/image/v%C3%ADa-a%C3%A9rea-de-mascara-lar%C3%ADngea?ruleredirectid=475
- Miller TL. High Flow Therapy and Specialty Gases:Heliox Ventilation and the Development of Precision Flow ® Heliox. Vapotherm Inc. 2012. Disponible en: http://cdn-ecomm.dreamingcode.com/public/246/documents/Version-20131001065459-Documents-246-9879-1.pdf
- González Gutiérrez S, Gutiérrez Lizardi P. Protocolos y procedimientos en paciente crítico: Neumokit. El manual Moderno: 1–2.
- Díaz V, Lagrutta F, Donato M. Protocolo para la inserción, cuidado y extracción del drenaje pleural en pacientes pediátricos. Hospital del niño Dr. José Renán Esquivel. 2020.
- Estrada Masllorens JM, Galimany Masclans J, Sarria Guerrero JA. Drenaje torácico cerrado. Sistema de recogida no reutilizable:Pleur-evac.Nursing.2012; 30 (6): 54–58.
- Procter LD. Shock - Cuidados críticos. Manual MSD versión para profesionales. 2022. Disponible en:https://www.msdmanuals.com/es/professional/cuidados-cr%C3%ADticos/shock-y-reanimaci%C3%B3n-con-l%C3%ADquidos/shock
- González Méndez MI, Urbán Carmona MR, Muriana Jiménez R. Medición de la presión venosa central-Manuales Clínicos-Procedimientos generales de Enfermería. Hospital Universitario Virgen del Rocío. Disponible en: https://manualclinico.hospitaluvrocio.es/procedimientos-generales-de-enfermeria/medicion-de-constantes-vitales/medicion-de-la-presion-venosa-central/
- González Méndez MI, Martín Castaño C, Urbán Carmona MR. Medición de la presión venosa central mediante monitor - Manuales Clínicos - Procedimientos generales de Enfermería. Hospital Universitario Virgen del Rocío. Disponible en: https://manualclinico.hospitaluvrocio.es/procedimientos-generales-de-enfermeria/medicion-de-constantes-vitales/medicion-de-la-presion-venosa-central-mediante-monitor/
- Copete Vega A, López Nuño JA, Isabel García A, Martín Mata I, Quesada Pérez N. Protocolo de actuación de enfermería en el manejo del catéter Swan-Ganz. HospitalInfantaCristina-Salud Madrid:Comunidad de Madrid;2009.Disponible en: https://intranethuic.com/wp-content/uploads/2015/06/PCE-PT-029-Protoclo-de-cuidados-en-el-manejo-del-cateter-SWAN-GANZ.pdf
- Elección del catéter venoso periférico (tipos,clasificación y usos). Yo amo enfermería blog.com.
- Parejo Arrondo M.Protocolo del catéter de línea media.Campusvygon.com. 2021. Disponible en: https://campusvygon.com/es/wp-content/uploads/sites/7/2021/03/Protocolo-midline-2021-1.pdf
- Pérez Espartero S. Catéteres multilumen: ¿Qué luz utilizar? Campusvygon.com. 2020. Disponible en:https://campusvygon.com/es/luces-cvc/
- Pineau M.Colocación de PICC: El método Zimyla tunelización, dos recursos claves para asegurar su éxito. Campusvygon.com. 2020. Disponible en: https://campusvygon.com/es/colocacion-de-picc-el-metodo-zim-y-la-tunelizacion-2-recursos-claves-para-asegurar-su-exito/
- Mantenimientoyobservacióndecatéteresumbilicales.Campusvygon.com. 2020. Disponible en:https://campusvygon.com/es/mantenimiento-umbilicales/
- Banco de preguntas Preevid.¿Se puede utilizar el catéter arterial para administrar medicamentos?. Murciasalud.es. 2015. Disponible en: https://www.murciasalud.es/preevid/20318
- Peco R. Anatomía relevante para la canalización de la arteria radial y femoral. Campus vygon.com. 2022. Disponible en: https://campusvygon.com/es/canalizacion-arteria-radial-y-femoral/
- Peco R. 9 claves para una canalización arterial exitosa.Campus vygon.com.2023. Disponible en: https://campusvygon.com/es/canalizacion-arterial-exitosa/
- Manrique Martínez I, Pons Morales S, Casal Angulo C, García Aracil N, Castejón De La Encina ME. Accesos intraóseos: revisión y manejo. Anales de Pediatría Continuada. 2013; 11 (3): 167–173. Disponible en: https://www.elsevier.es/es-revista-anales-pediatria-continuada-51-articulo-accesos-intraoseos-revision-manejo-S1696281813701343
- Romero-García M,de la Cueva-ArizaL, Delgado-Hito P.Actualización en técnicas continuas de reemplazo renal. Enfermería Intensiva. 2013; 24 (3): 113–119. Disponible en: https://www.elsevier.es/es-revista-enfermeria-intensiva-142-articulo-actualizacion-tecnicas-continuas-reemplazo-renal-S1130239913000217
- Fernández Lafever SN, Santiago Lozano MJ, López-Herce Cid J. Técnicas de depuración extrarrenal continua en pediatría. An Nefrol Pediátr. 2023; 1 (7): 200–207. Disponible en: https://analesnefrologiapediatrica.com/tecnicas-de-depuracion-extrarrenal-continua-en-pediatria/
- Santiago Lozano MJ, López-Herce Cid J, Bermúdez Barrezu et aL, Belda Hofheinz
- S.Protocolo de técnicas de depuración extrarrenal.Sociedad y fundación española de cuidados intensivos pediátricos (SECIP). 2020. Disponible en: https://www.secip.info/images/uploads/2020/09/PROTOCOLO-TECNICAS-DE-DEPURACION-EXTRARRENAL.pdf
- Madurga Revilla P, García Íñiguez J P, Domínguez Caja lM, López Pisón J. Utilidad de la escala de coma de Glasgow para el pediatra de Atención Primaria.Form Act Pediatr Aten Prim. 2017; 10 (1): 45–48. Disponible en: https://fapap.es/files/639-1477-RUTA/07_Escala_Glasgow.pdf
- Fernández-Jaén A, Calleja-Pérez B, García-Asensio J. Traumatismo craneoencefálico en la infancia. Medicina Integral. 2001; 37 (8): 337–345. Disponible en:https://www.elsevier.es/es-revista-medicina-integral-63-articulo-traumatismo-craneoencefalico-infancia-12003811
- Soetenga DJ. Saturación regional de oxígeno:el nuevo signo vital.Nursing.2008; 26 (5): 40–41.
- Marín-Caballos AJ, Murillo-Cabezas F, Domínguez-Roldan JM, Leal-Noval SR, Rincón-Ferrari MD, Muñoz-Sánchez MÁ. Monitorización de la presión tisular de oxígeno (PtiO2) en la hipoxia cerebral: aproximación diagnóstica y terapéutica. Medicina Intensiva. 2008; 32 (2): 81–90. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0210-56912008000200005&lng=es&nrm=iso&tlng=es
- Casado Flores J. Diagnóstico de muerte cerebral en niños y neonatos. Particularidades diagnósticas. Medicina Intensiva. 2000; 24 (4): 167–175. Disponible en: http://www.medintensiva.org/es-diagnostico-muerte-cerebral-ninos-neonatos--articulo-13010774
- Bonillo Caballero MC, Rodríguez Pérez N, Bonillo Caballero M, Yagüe Perandrés A,Tomás Cantos P, Orellana MuñozL,et al.Tema 6:Actuación de enfermería en el proceso de donación de órganos. SalusPlay. Disponible en: https://www.salusplay.com/apuntes/cuidados-intensivos-uci/tema-6-actuacion-de-enfermeria-en-el-proceso-de-donacion-de-organos
- Escudero Augusto D, Martínez Soba F, de la Calle B, Pérez Blanco A, Estébanez B, Velasco J, et al. Cuidados intensivos orientados a la donación de órganos. Recomendaciones ONT-SEMICYUC. Medicina Intensiva. 2021; 45 (4): 234–242. Disponible en: http://www.medintensiva.org/es-cuidados-intensivos-orientados-donacion-organos--articulo-S0210569119302372
- Equipo de coordinación de trasplantes del Hospital Universitario Dr.Peset, Coordinación autonómica de trasplantes de la DGAS, Servicio de transformación del modelo asistencialde la DGAS. Guía del proceso de donación de órganos en los cuidados al final de la vida de los pacientes ingresados en hospitales de atención a enfermos crónicos y de larga estancia y en unidades de hospital a domicilio. Conselleria de Sanitat Universal i Salut Pública-Generalitat Valenciana. 2022. Disponible en: https://www.san.gva.es/documents/d/assistencia-sanitaria/guia-de-manejo-donantes_had_hacle_v2_20221025_es-1
- Grupo de trabajo de la Asociación Española de Pediatría(AEP),Grupo de trabajo de la Organización Nacional de Trasplantes (ONT).Recomendaciones nacionales sobre donación pediátrica. AEP - ONT. 2020. Disponible en: https://www.ont.es/wp-content/uploads/2023/06/Recomendaciones-Nacionales-sobre-Donacion-Pediatrica.-Mayo-2020.pdf
- Pérez Alonso A. Monitorización capnográfica en el paciente pediátrico. III Jornadas Enfermería de Urgencias Pediátricas (SEUP). 2013.
- Sosa I, Cardetti M, Favareto V, Maure C, Ceballos E, Abona H, et al. Capnografía en reciénnacidos en ventilación mecánica y su relación con la medición de CO2 en muestras sanguíneas.Anales de Pediatría. 2022; 97 (4): 255–261. Disponible en: https://www.analesdepediatria.org/es-capnografia-recien-nacidos-ventilacion-mecanica-articulo-S1695403322000169
- Beatriz L, Novelo C, Trinidad D, González T. Evaluación de la presión intraabdominal por el método intravesical. Desarrollo Cientif Enferm. 2011; 19. Disponible en: https://www.index-f.com/dce/19pdf/19-144.pdf
