4.1 INTRODUCCIÓN
4.1.1 Aspectos neurofisiológicos del recién nacido
El sistema nervioso del recién nacido se caracteriza por su inmadurez.
Durante la vida intrauterina, el feto que se desarrolla con normalidad muestra actividades y movimientos que van a preparar al recién nacido para muchos comportamientos vitales de la vida extrauterina: comienzan a producirse los primeros movimientos de la pared torácica, se empiezan a observar movimientos de brazos y pies y se desarrollan el reflejo de búsqueda, así como los primeros movimientos de succión y deglución.
Durante el último trimestre de gestación se produce el crecimiento, diferenciación celular y mielinización del sistema nervioso central, que durará hasta los 3 o 4 años de vida del niño. Además, a partir de este tercer trimestre de gestación, las vías nociceptivas son funcionales, es decir, los recién nacidos presentan madurez anatómica y funcional para percibir el dolor.
4.1.2 Examen neurológico
Según Prechtl se pueden diferenciar cinco estados de sueño-vigilia, siendo los estados más eficaces para valorar neurológicamente a un niño y tomar sus constantes vitales el tres y el cuatro:

Para poder realizar el examen neurológico del recién nacido, tendremos en cuenta:
- Capacidad de despertar y mantener el nivel de alerta.
- Examen morfológico para identificar posibles anomalías, contracturas, deformidades o asimetrías.
- Patrón motor: Valoraremos los movimientos espontáneos, el tono muscular y la la fuerza muscular. El tono muscular pasivo se valora observando la postura del recién nacido y la resistencia a los movimientos pasivos. La característica propia del tono muscular pasivo del recién nacido a término es su predominio en flexión de las cuatro extremidades, con cierto grado de hipertonía fisiológica. El tono muscular activo se valora observando la respuesta del recién nacido frente a una situación ante la que él debe responder.
- Presencia de reflejos primarios: Consiste en un conjunto de reacciones involuntarias que se producen ante la aparición de estímulos y que favorecen la supervivencia del neonato durante la primera etapa de su desarrollo. Su presencia se justifica por la inmadurez del sistema nervioso central del recién nacido, que le impide realizar movimientos voluntarios y coordinados. Su ausencia es signo de depresión neurológica neonatal, ya que muchos están relacionados con funciones vitales como la alimentación.
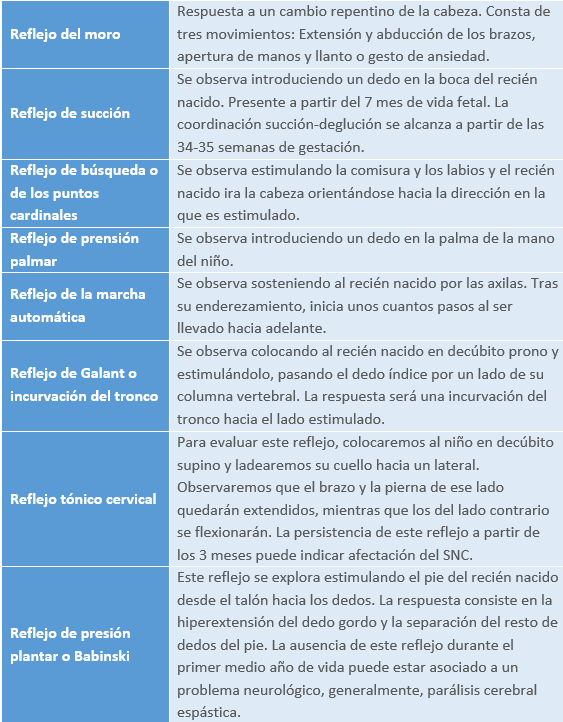
Cuando evaluamos los reflejos primitivos en un recién nacido, se tendrán en cuenta tanto la intensidad de los reflejos como la cronología.
- De 0 a 4 semanas, observaremos estos reflejos en su máxima intensidad.
- De 8 a 12 semanas, las respuestas reflejas comenzarán a disminuir hasta su desaparición.
- A partir de las 12 semanas, si los reflejos persisten de forma clara, nos puede indicar que existe posibilidad de una patología en el sistema nervioso.
- Examen sensorial: Es decir, valoraremos la capacidad de respuesta del recién nacido frente a estímulos. Dentro de este apartado, podemos evaluar el reflejo cocleopalpebral para evaluar la audición del recién nacido.
4.1.3 Signos potenciales de alarma
- Alteraciones sueño-vigilia. En forma de irritabilidad excesiva (con dificultad para ser consolado) o, por el contrario, letargia (con dificultad para despertarlo).
- Alteraciones en el tono muscular: hipertonía o hipotonía.
- Movimiento limitado o hipotonico de una de las partes del cuerpo en comparación con el resto.
- Reflejos de búsqueda, succión y deglución ausentes o incoordinados.
- Aparición de convulsiones.
4.2 NEUROMONITORIZACIÓN EN EL RECIÉN NACIDO
Para atender al recién nacido con alto riesgo neurológico, utilizaremos dos herramientas: el electroencefalograma integrado por amplitud (aEEG) y la oxigenación cerebral con espectroscopia cercana al infrarrojo (saturación regional de oxígeno o NIRS).
4.2.1 Electroencefalograma integrado por amplitud (aEEG)
La electroencefalografía integrada de amplitud (aEEG) es un método de monitorización continua de la función cerebral. Se basa en la aplicación de unos electrodos en el cuero cabelludo del recién nacido, a través de los cuales se mide la actividad eléctrica cortical, traducida en un trazado que se visualiza en el monitor.
Este método está diseñado para analizar cambios y tendencias en la actividad eléctrica cerebral, así como detectar actividad paroxística (episodios convulsivos).
Su uso, ayuda a mejorar el diagnóstico y el tratamiento de las crisis epilépticas, y, en los pacientes con lesión hipóxica-isquémica, colabora en establecer el grado de gravedad de la encefalopatía en fase aguda, así como el establecimiento del pronóstico neurológico del paciente desde una fase precoz.
Colocación de los electrodos
Los electrodos más utilizados son los de aguja y los de hidrogel. Para monitorizaciones prolongadas se recomiendan los electrodos de aguja, ya que minimizan las interferencias, disminuyen la impedancia (es decir, la resistencia que se ofrece al flujo de corriente eléctrica) y son capaces de obtener una mejor calidad de registro. Para monitorizaciones breves, se recomiendan los electrodos de hidrogel.
La localización de los electrodos sigue las recomendaciones del sistema 10-20 internacional.
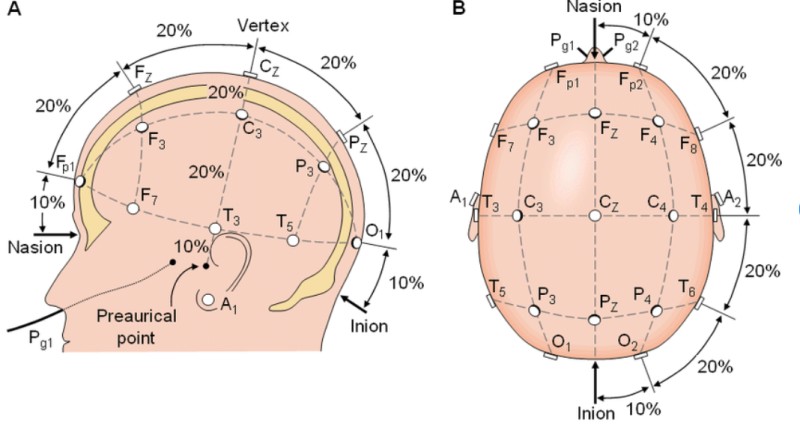
Imagen 10. Fuente: Internet.
Los electrodos se nombran según la región cerebral sobre la que están situados, con una numeración, de menor a mayor, desde las áreas anteriores a posteriores y con números impares para el hemisferio izquierdo y pares para el derecho.
- Registros de un único canal: Miden la actividad cortical de ambos hemisferios cerebrales. Se utilizan dos electrodos biparietales P3-P4 y un electrodo de referencia, que se colocará en la zona frontal (evitando la fontanela o zonas edematosas) o en la escápula. La función del electrodo neutral es disminuir las interferencias.
- Para registros de dos canales: Miden la actividad de cada hemisferio de forma independiente. Se necesitan cuatro electrodos C3-P3 (hemisferio izquierdo) y C4-P4 hemisferio derecho. Entre C3 y P3 y C4-P4 debemos dejar un espacio mínimo de 2,5 cm. Debe existir simetría interhemisférica.
Preparación de la piel:
- Si vamos a usar electrodos de aguja: Desinfectar la piel con clorhexidina acuosa 2%. Introducir la aguja dirigiéndola hacia la cara del paciente y fijar con esparadrapo de tela en forma de T.
- Si se va a utilizar un electrodo de hidrogel, exfoliar la piel primer del punto seleccionado y retirar los restos del exfoliante con agua bidestilada. Colocar el electrodo. Para mejorar la adherencia, se puede utilizar esparadrapo por encima del mismo y colocar una venda de gasa sujetando los electrodos.
- Una vez colocados los electrodos, los conectaremos con su puerto en la petaca, encenderemos el monitor y comenzaremos la monitorización.
Interpretación del trazado
Para interpretar y clasificar correctamente un trazado en un aEEG, nos vamos a fijar en lo siguiente:
- Trazado de fondo.
- Ciclos vigilia-sueño.
- Existencia de actividad paroxística.
1. Trazado de fondo
Los trazados de base van a describir la actividad electrocortical predominante en el registro. A la hora de leer un trazado de base, prestaremos atención a los márgenes superior e inferior y a la variabilidad del trazado, de forma que, en función de los anteriores elementos, podremos identificar una serie de patrones:
- Continuo: actividad continua con amplitud mínima entre 5 y 10 µV y máxima entre 10-25 (–50) µV.
- Discontinuo: trazado discontinuo con amplitud mínima variable, pero < 5 µV, y amplitud máxima > 10 µV.
- Brote-supresión: trazado discontinuo con amplitud mínima sin variabilidad entre 0-1 (2) µV y brotes con amplitud > 25 µV. Puede ser brote suspensión positivo: densidad brotes ≥ 100 brotes/h; o brote suspensión negativo: densidad de brotes < 100 brotes/h.
- Voltaje bajo: trazado de base continuo de voltaje muy bajo ( ≤ 5 µ V); amplitud máxima < 10 µς
- Inactivo, plano: trazado isoeléctrico por debajo de 5 µV.
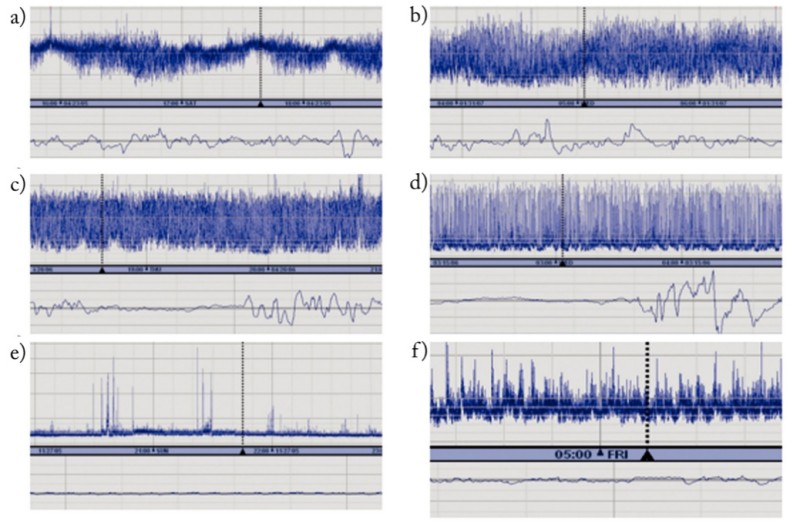
Imagen 11. Clasificación de trazados de base de electroencefalografía integrada de amplitud. a) Continuo con ciclos de vigilia-sueño maduros en niño a término. b) Continuo alternando con discontinuo con ciclos de vigilia-sueño inmaduros en niño prematuro. c) Discontinuo. d) Brote-supresión. e) Inactivo. f) Hipovoltado.. Bibliografía: Valverde E, García-Alix A, Blanco D. Monitorización continua de la función cerebral mediante electroencefalografía integrada de amplitud. An Pediatr Contin. 2008;6(3):169-173.
2. Valoración de ciclos sueño-vigilia
Los ciclos vigilia-sueño se visualizan en el registro como variaciones sinusoidales en la banda. La banda más estrecha corresponde al trazado continuo durante la vigilia y sueño activo, y la banda ancha, al trazado discontinuo durante el sueño tranquilo. Es importante reconocerlos, ya que son un indicador de la integridad de la función cerebral y de maduración del sistema nervioso central.
3. Presencia de actividad paroxística.
La actividad paroxística se reconoce en el registro como una elevación abrupta en la amplitud mínima, con frecuencia acompañada de una elevación en la amplitud máxima.
Las crisis se pueden presentar de las siguientes formas:
- Crisis aislada
- Crisis repetidas: crisis que aparecen con frecuencia superior a una por cada 30 minutos de intervalo.
- Estatus epiléptico: actividad epiléptica continua durante > 30 min.
Trazados de aEEG característicos en diferentes situaciones clínicas
Encefalopatía
En recién nacidos que hayan sufrido asfixia perinatal y presenten clínica de encefalopatía hipóxico-isquémica, en las primeras 6-12 horas de vida, la monitorización con aEEG ha demostrado su validez para determinar tanto la gravedad de la encefalopatía como su pronóstico de forma temprana. Por lo general, los trazados anómalos (brote-supresión, voltaje bajo, inactivo) se asocian a un pronóstico desfavorable, con secuelas neurológicas graves.
Es importante analizar la evolución de los patrones de aEEG durante las primeras 48 horas tras la lesión hipóxico-isquémica, ya que una mejoría de las características del trazado y la aparición de ciclos sueños-vigilia antes de las 36 horas de vida, mejoran el pronóstico del recién nacido.
Prematuridad
El trazado de base del recién nacido prematuro se caracteriza por la discontinuidad, es decir, por presentar periodos de brotes de voltaje elevado intercalados con periodos de amplitud baja. A medida que el sistema nervioso central del niño madura, en el aEEG aparece un porcentaje de continuidad mayor.
En cuanto a la presencia de ciclos vigilia-sueño, a partir de las 30 semanas de gestación se reconocen claramente en el registro, pero, pueden estar, aunque de una forma más rudimentaria, a partir de las 25-26 semanas.
Cuando se produce una hemorragia intraventricular, patología común en el recién nacido prematuro, se pueden llegar a identificar una serie de cambios tempranos en la fase aguda. Son cambios inespecíficos caracterizados por una depresión de la amplitud del trazado de base, aumento de la discontinuidad y por la presencia de actividad epiléptica hasta en un 75% de los pacientes.
Las convulsiones son un signo clínico neurológico frecuente en el período neonatal, sin embargo, tan sólo el 20% de las crisis neonatales eléctricas provocan signos clínicos, el resto pueden pasar inadvertidas.
El seguimiento electroencefalográfico mediante aEEG es una herramienta eficaz en la detección de crisis epilépticas convulsivas subclínicas, así como para determinar sus características y la respuesta al tratamiento anticonvulsivo.
Cuidados de Enfermería en la monitorización con aEEg.
- Colocar y mantendremos los electrodos adecuadamente.
- Verificar frecuentemente la impedancia óptima de cada electrodo (<5kOhms, pero se aceptan
- Interpretaremos los trazados de fondo y sus cambios en las tendencias, así como reconoceremos las crisis paroxísticas y los ciclos sueño-vigilia.
- Revisaremos en tiempo real y de forma retrospectiva el trazado para verificar que no se han producido cambios en el trazado o actividad paroxística que haya pasado desapercibida.
- En presencia de actividad paroxística, registraremos tanto la duración como los signos clínicos, si los hubiera (movimientos oculares, hipo, chupeteo, contracciones musculares). Comunicaremos de forma rápida esta información al neonatólogo para instaurar tratamiento farmacológico.
- Registraremos en el monitor: signos clínicos de actividad paroxística, así como cambios posturales, cuidados, procedimientos y administración de fármacos inotrópicos, sedantes, relajantes musculares y antiepilépticos; hemoderivados o expansiones de volumen que puedan causar interferencias en el trazado.
- Explicaremos el aEEG con un lenguaje adaptado a la familia para minimizar el estrés asociado a la monitorización y facilitaremos la interacción de los progenitores con su bebé sin que el aEEG constituya una barrera.
4.2.2 Oxigenación cerebral con espectroscopia cercana al infrarrojo (saturación regional de oxígeno o NIRS)
La monitorización de la saturación regional cerebral mediante espectroscopia cercana al infrarrojo (NIRS) constituye un indicador muy útil de la estabilidad fisiológica y la hemodinámica cerebral. Proporciona una valoración continua y no invasiva de la oxigenación y el metabolismo cerebral, así como refleja el balance final entre el suministro y el consumo de oxígeno tisular.
La zona que se monitoriza es la región perfundida por las arterias cerebrales media y anterior, que son particularmente vulnerables a las agresiones hipóxico-isquémicas.
Los valores normales se encuentran entre 55-85% pero es importante valorar siempre la tendencia, ya que existen situaciones de riesgo para el cerebro que a priori entrarían dentro de los límites normales:
- Descensos >20-25% de los valores basales.
- Saturación regional de oxígeno cerebral <40% de forma aguda, aunque no sea mantenido en el tiempo; o bien, < 50% de forma sostenida.
- Valores por encima de 90%.
- Diferencia >20% entre ambos hemisferios cerebrales.
Existe una situación especial, que es el recién nacido con encefalopatía hipoxico-isquemica. En estos neonatos, vamos a encontrar valores de NIRS elevados en las primeras 48 horas de vida, ya que existe una menor utilización de oxígeno debido al daño mitocondrial.
Colocación de los sensores cerebrales
- Se pueden colocar uno o dos sensores cerebrales. Se colocan en la frente del paciente, bajo la línea del cabello, a ambos lados de la línea media. Nunca sobre el seno sagital superior.
- La zona elegida no deberá presentar edema, cabello, hematomas o malformaciones arteriovenosas. Elegiremos una zona de piel sana.
- Para colocar el sensor, limpiaremos la piel antes con agua.
- En pieles de alto riesgo (prematuridad) podemos tener la precaución de pegar y despegar varias veces el sensor sobre una superficie limpia antes de colocarlo sobre la piel.
- Rotaremos la posición del sensor cambiando el punto de apoyo cada doce horas para evitar lesiones por decúbito.
Consideraciones importantes
- Pueden existir alteraciones en las mediciones si existe luz intensa (fototerapia) o movimientos excesivos. En condiciones de luz intensa, los valores pueden ser falsamente altos y, en entornos más oscuros, falsamente bajos.
- Existen situaciones que alteran la fiabilidad de la monitorización: ictericia, anemia, hemoglobina baja, carboxihemoglobina y otras alteraciones.
- Pruebas complementarias: Los sensores deben retirarse en caso de resonancia magnética, pero no es necesario en caso de radiografía simple o TAC.
4.3 ENCEFALOPATÍA HIPÓXICO-ISQUÉMICA. HIPOTERMIA ACTIVA Y PASIVA
La asfixia perinatal es una agresión producida al feto que se produce por una privación de oxígeno y/o de perfusión tisular (hipoxia-isquemia) alrededor del nacimiento.
Este episodio de asfixia puede dañar órganos como el riñón, el corazón, el hígado y especialmente el sistema nervioso central. Cuando esto último ocurre, el recién nacido puede desarrollar una encefalopatía hipóxico-isquémica.
La encefalopatía hipóxico-isquémica perinatal (EHI) es un síndrome clínico de disfunción neurológica aguda y gravedad variable que presenta el recién nacido, inmediatamente tras el nacimiento, después de un episodio de asfixia perinatal. Se caracteriza por deterioro del nivel de alerta, alteraciones en el tono muscular y las respuestas motoras y, en ocasiones, convulsiones.
Esta patología se considera uno de los problemas de salud más graves para el recién nacido. Es la principal causa de mortalidad en el recién nacido a término y prematuro tardío. También es considerada la principal causa de morbilidad neurológica grave en los pacientes supervivientes y es responsable del 20% de los casos de parálisis cerebral en la infancia.
4.3.1 Mecanismo de acción del daño hipóxico-isquémico
En la mayoría de los casos se desconocen las causas que originan la encefalopatía hipóxico-isquémica, pero se han establecido una serie de indicadores perinatales que indican riesgo de que aparezca cuando están presentes:
- Evidencia de estrés fetal: anomalías en la frecuencia cardiaca como bradicardia fetal, líquido amniótico meconial, pH del cuero cabelludo <7,20.
- Evidencia de evento centinela: desprendimiento de placenta, rotura uterina, prolapso de cordón, embolismo de líquido amniótico, parada cardiaca materna, nudo verdadero de cordón y hemorragia fetomaterna.
- Depresión neonatal: Apgar inferior o igual a 5 a los cinco minutos. Necesidad de ventilación con presión positiva en la reanimación.
- Gasometría de cordón o en la primera hora de vida: pH menor o igual a 7 o exceso de bases mayor o igual a 16.
El daño hipóxico-isquémico es un proceso complejo que comienza con la agresión y continúa durante el proceso de recuperación. Se desarrolla en varias fases:
- Fallo energético primario: Se produce inmediatamente tras la agresión hipóxico-isquémica. Al reducirse el flujo sanguíneo cerebral se produce un deterioro del metabolismo que ocasiona un primer fallo energético y, en consecuencia, muerte neuronal por necrosis celular.
- Fase latente: Esta fase dura unas 6 horas. Se restablece la circulación y/o la oxigenación durante un tiempo limitado, lo que favorece una recuperación parcial del metabolismo oxidativo. A esta fase también se la conoce como “ventana terapéutica”, ya que una intervención neuroprotectora podría ayudar a reducir el daño, por lo que esta fase es un periodo ideal para iniciar tratamiento.
- Fallo energético secundario: Se producen alteraciones bioquímicas, moleculares y celulares en cascada que producen un fallo energético irreversible, que conduce a una lesión cerebral permanente.
4.3.2 Caracterización de la EHI perinatal según gravedad
Cuando tenemos un recién nacido con edad gestacional igual o superior a las 36 semanas que tiene indicadores perinatales de asfixia, se recomienda realizar un examen neurológico sistemático y estructurado para evaluar la presencia y gravedad de la EHI.
Para facilitar la caracterización de la EHI se pueden utilizar escalas validadas como la escala García-Alix. Esta escala ha demostrado tener una alta fiabilidad y validez para evaluar de forma sistematizada y homogénea las características de la gravedad de la EHI en las primeras 6 horas de vida del RN. Consta de cinco ítems clínicos y tres relacionados con el electroencefalograma integrado por amplitud. Dentro de los ítems clínicos valora el nivel de alerta del recién nacido, el tono muscular o postura (valorando al neonato en decúbito supino), la actividad motora espontánea, la respuesta motora al aplicar estímulos, los reflejos miotáticos (reflejo patelar, reflejo aductor y reflejo aquíleo) y el patrón respiratorio.
Si la puntuación obtenida en la escala es menor de 8 la EHI es leve, si la puntuación está entre 8 y 30 es moderada y si es mayor de 30 la EHI es grave.
Caracterizar la gravedad de la EHI nos va a permitir determinar si el paciente es candidato para recibir tratamiento con hipotermia terapéutica, así como determinar una primera aproximación pronóstica, ya que existe una correlación clara entre la gravedad de la EHI y la probabilidad de muerte o secuelas en el sistema nervioso del recién nacido.
- EHI leve (puntuación en la escala García-Alix <8): El estado de conciencia se caracteriza por un periodo de letargia inicial seguido de un periodo de hiperalerta e irritabilidad. Los reflejos, el tono muscular y los movimientos espontáneos son normales. No conlleva ningún riesgo de mortalidad ni de minusvalía moderada o severa ulterior, aunque entre un 6 y un 24% presentan leves retrasos en el desarrollo psicomotor.
- EHI moderada (puntuación entre 8 y 30 en la escala García-Alix): El recién nacido con EHI moderada puede permanecer letárgico los dos o tres primeros días. Se caracteriza por presentar hipotonía global las 12 primeras horas. Pueden presentar hiperactividad parasimpática y convulsiones aisladas o repetidas. La recuperación es variable, algunos mejoran en 72 horas, otros empeoran. Existe un riesgo de muerte cercano al 3% y un 20-45% de los supervivientes presentarán discapacidad.
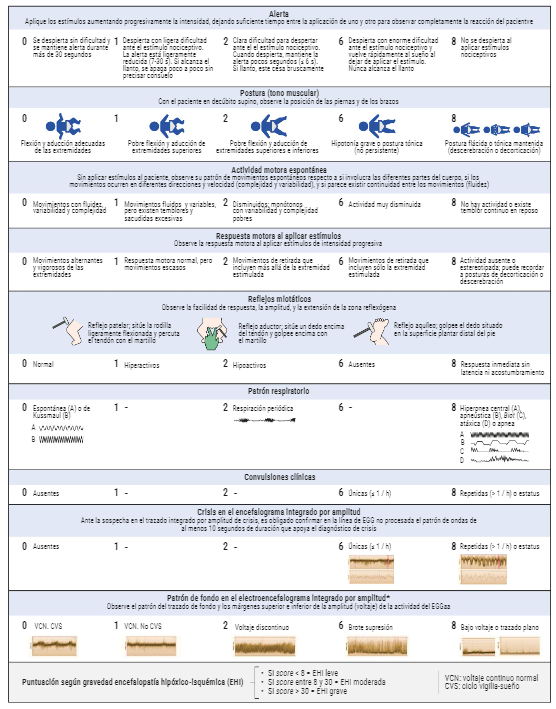
Imagen 12. Adaptada de: García-Alix A, Arnaez J, Arca G, Agut T, Alarcon A, Martín-Ancel A, et al. Development, Reliability, and Testing of a New Rating Scale for Neonatal Encephalopathy. J Pediatr. 2021 Aug;235:83-91
- EHI grave (puntuación en la escala García-Alix >30): El recién nacido está estuporoso o en coma, intensamente hipotónico y existe un mayor riesgo de presentar convulsiones sutiles y clónicas multifocales. Pasadas las primeras 24-72 horas de vida, el cuadro puede empeorar, con agudización del deterioro de la capacidad para despertar, disfunción del tronco encefálico y signos de hipertensión intracraneal. La mortalidad que presentan estos pacientes es muy elevada, entre un 50-75%. Entre los supervivientes, un número importante fallecerá durante el primer año y, prácticamente todos, desarrollarán secuelas neurológicas graves.
4.3.3 Tratamiento con hipotermia terapéutica
El tratamiento estándar de la encefalopatía hipóxico-isquémica es la hipotermia terapéutica, ya que es la única intervención neuroprotectora que ha demostrado ser eficaz para tratar la EHI, reduciendo la mortalidad y la discapacidad grave.
La neuroprotección con hipotermia se basa en el concepto de la lesión secundaria al evento hipóxico-isquémico como un proceso que se desarrolla y evoluciona en el tiempo. Recordemos que el daño hipóxico-isquémico tenía tres fases: una fase inicial e inmediata a la agresión, en la que se produce daño neuronal; una fase secundaria caracterizada por una recuperación parcial del mecanismo oxidativo del cerebro, caracterizada por la reperfusión del tejido cerebral; y, por último, una última fase caracterizada por un segundo fallo energético.
Aunque, hoy en día, se desconoce el mecanismo de acción de la hipotermia terapéutica, parece que su papel neuroprotector está relacionado con la reducción del metabolismo cerebral (5% de reducción con cada grado centígrado que se desciende la temperatura cerebral). Además, la hipotermia tiene un efecto múltiple al suprimir importantes vías de lesión que se activan durante la fase latente:
- Disminuye la formación de radicales libres de oxígeno.
- Reduce la muerte celular programada o apoptosis (principal causa de muerte neuronal en el cerebro inmaduro).
- Inhibe la liberación de glutamato.
- Mejora la síntesis proteica.
- Reduce la liberación de NO y excitotoxinas.
- Disminuye la excitabilidad neuronal.
- Mejora la preservación de antioxidantes endógenos.
Criterios de indicación de hipotermia terapéutica
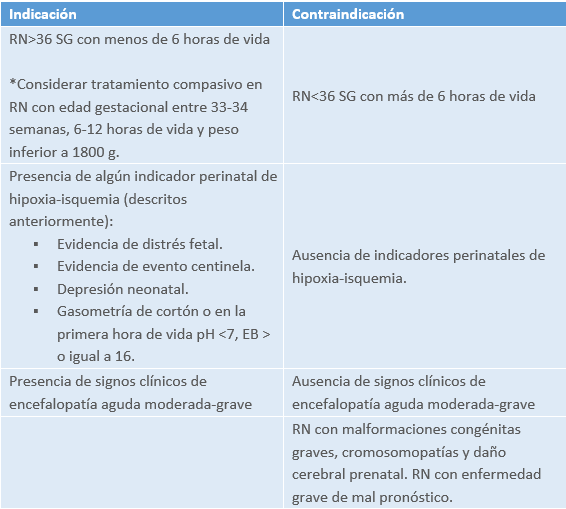
Modalidades de hipotermia terapéutica
Dentro de las modalidades de hipotermia terapéutica encontramos 2 tipos principalmente:
- Hipotermia pasiva: Consiste en disminuir la temperatura central del recién nacido hasta 34 grados al no aplicar medidas de calentamiento activo (incubadora, cuna térmica). Su aplicación se restringe a la fase de estabilización en la sala de partos, transporte intra y extrahospitalario para evitar la demora en el inicio de tratamiento con hipotermia activa y, transitoriamente, en UCIN hasta categorizar la gravedad de la encefalopatía y determinar si el recién nacido cumple criterios para recibir hipotermia activa.
- Hipotermia activa: Consiste en disminuir la temperatura del recién nacido mediante un enfriamiento corporal o selectivo de la cabeza, utilizando dispositivos de enfriamiento que funcionan con servocontrol. La aplicación de hipotermia activa se realiza en tres fases:
- Enfriamiento: En unos 15-20 minutos, hasta alcanzar los 33-34º. Esta fase se debe iniciar antes de las 6 horas de vida.
- Mantenimiento (72 horas).
- Recalentamiento hasta alcanzar los 36.5ºC. La fase de recalentamiento debe de llevase a cabo de forma lenta, a razón de 0. 5º C la hora, para evitar la aparición de convulsiones.
Actitud terapéutica en el recién nacido con sospecha de EHI.
Para asegurar a los recién nacidos el acceso a la hipotermia terapéutica en las primeras 6 horas de vida, es necesario considerar la encefalopatía hipóxico-isquémica como una emergencia neurológica.
- Actuación en el nacimiento y traslado del recién nacido.
Cuando un RN cumple indicadores de hipoxia-isquemia en el nacimiento, el equipo asistencial procederá a estabilizar la función cardiorrespiratoria del recién nacido.
- Monitorización de la frecuencia cardiaca y saturación de oxígeno preductal.
- Comenzar la ventilación con FiO2 0,21.
Una vez recuperada la ventilación y la frecuencia cardiaca, se apagará la cuna de calor radiante y se monitorizará la temperatura central, que debe estar entre los 34-36ºC.
En este momento, se activará el “Código hipotermia”: Se realizará el traslado a la Unidad de Cuidados Intensivos Neonatal en hipotermia pasiva. Si el nacimiento se produjera en un hospital sin programa de hipotermia terapéutica, se establecerá contacto con el centro de referencia más cercano y se trasladará urgentemente al recién nacido en hipotermia pasiva, es decir, con la incubadora apagada, sin gorro y monitorizando en todo momento la temperatura rectal.
Durante esta cadena de intervenciones es importante evitar:
- Hipo/ hiperoxia.
- Sobreenfriamiento.
- Expansiones de volumen, bolos de bicarbonato y calcio.
- Estrés ambiental. Es importante optimizar siempre el confort del recién nacido en todo momento (maniobras de contención, facilitar un primer contacto con los padres).
- Actuación en la UCIN: Recién nacido con HT pasiva.
Se colocará al recién nacido en una cuna térmica apagada, se monitorizará la función cardiorrespiratoria y conectaremos el soporte respiratorio que precise el recién nacido.
Continuaremos la monitorización continua de la temperatura rectal o esofágica en el monitor, para mantener la temperatura central entre 33-34ºC.
Monitorizaremos también neurológicamente al recién nacido, con aEEG y oxigenación cerebral con espectroscopia cercana al infrarrojo (NIRS). Revisaremos impedancia, valoración horaria del trazado de fondo, con especial atención a la aparición de patrones anómalos y crisis paroxísticas eléctricas, así como tendencia en NIRS. En el recién nacido con encefalopatía hipóxico-isquémica proporcionan información importante de la integridad del sistema nervioso central de una manera continua y no invasiva. Este tipo de monitorización no impide a los progenitores que puedan sostener en brazos a su bebé.
Durante la interacción con el RN valorar y documentar el estado de consciencia, tono y postura, así como la presencia de movimientos sugestivos de crisis paroxísticas.
Es importante planificar y aplicar cuidados desde un enfoque neuroprotector, no sólo para favorecer el bienestar del recién nacido y la familia, sino para también minimizar las fluctuaciones en el flujo sanguíneo cerebral, evitando incrementar el daño:
- Reducir estímulos ambientales como luz intensa o ruido: utilizar cobertores, focos individualizados, utilizar un tono de voz bajo alrededor del recién nacido, uso de sonómetros.
- Evitar olores fuertes cerca del recién nacido, facilitar la exposición al olor materno (utilizar calostro materno).
- Tratar el dolor y favorecer el confort y el descanso. Aprovechar la monitorización con aEEG para identificar y no interrumpir el sueño tranquilo.
- Ajustar el ritmo de los cuidados según tolerancia del recién nacido.
- Asegurar la presencia y el contacto físico con los padres.
El cuidado postural de este tipo de pacientes es importante:
- Colocación del recién nacido en decúbito supino o lateral, mantener cabecero elevado (15-30º); respetar flexión, contención y aproximación a la línea media con ayuda de dispositivos como nidos.
- Evitar la hiperextensión cervical, retracción escapular, abducción de la cadera y eversión de los pies. No subir las piernas en ángulo de 15º para evitar incrementar la presión intraabdominal.
- Movilizar la cabeza lentamente, mantenerla en posición neutral.
El nacimiento y la hospitalización de un niño tras un episodio de asfixia perinatal es un acontecimiento traumático para la familia, ya que acarrea un ingreso en un medio extraño, como es la Unidad de Cuidados Intensivos, a veces, incluso, en un hospital diferente al del nacimiento. Todo esto produce separación familiar, miedo e incertidumbre. Es importante llevar a cabo una acogida personalizada y una atención centrada en la familia.
- Establecer un contacto precoz y cercano con los progenitores, con el objetivo de establecer una relación de confianza que minimice el impacto emocional que produce la UCIN.
- Facilitar la presencia y la participación de los padres en el cuidado del RN, favoreciendo su empoderamiento como cuidadores principales y amortiguando su estrés.
- Utilizar la escucha activa y facilitaremos un espacio para expresar las emociones.
- Es importante proporcionar información básica con lenguaje ajustado a la realidad, de manera que sea sencilla de comprender para los padres. Esta información será consensuada por el equipo con el objetivo de evitar incoherencias o contradicciones y adaptada a la evolución clínica del recién nacido.
- Brindar acompañamiento y apoyo emocional durante el ingreso, para que puedan afrontar la hospitalización y el desenlace del proceso de la mejor manera posible.
- Actuación en la UCIN. RN con HT activa: inducción, mantenimiento y recalentamiento.
Debemos tener en cuenta que el recién nacido sometido a hipotermia terapéutica, que ha sufrido un daño hipóxico-isquémico, puede tener daños en múltiples órganos y estar gravemente enfermo. Se han descrito los siguientes efectos sistémicos y metabólicos:
- Coagulopatía, trombocitopenia, inmunosupresión.
- Acidosis láctica, hipocloremia, hiponatremia, hipo/ hiperglucemia.
- Disminución de la frecuencia cardiaca.
- Riesgo de edema cerebral.
- Vasoconstricción pulmonar, secreciones más espesas, menor producción de dióxido de carbono.
- Disminución del metabolismo hepático de los fármacos.
- Necrosis intestinal.
- Riesgo de úlceras. Necrosis grasa subcutánea.
Durante el tratamiento es importante realizar un estrecho control y vigilancia de la homeostasis global, así como del estado neurológico, para evitar complicaciones que pueden agravar el daño ocasionado por la hipoxia-isquemia. Durante todo el tratamiento es importante controlar:
- Controlar la temperatura central.
- Control de la tensión arterial media (en torno a 45-55 mmHg).
- Evitar hipo/ hiperoxia. Evitar hipo/ hipercapnia.
- Identificar precozmente crisis epilépticas, tanto clínicas como subclínicas a través de monitorización cerebral.
- Evitar hipo e hipermagnesemia.
- Mantener glucemia 70-100 mg/dl.
- Evitar el estrés y el dolor a lo largo de todo el tratamiento, ya que se ha descrito como un importante factor comórbido en la encefalopatía hipóxico-isquémica y la hipotermia terapéutica.

INDUCCIÓN A LA HIPOTERMIA (30-40 min):
- Monitorización continua de constantes vitales (FC, FR, TA, saturación de oxígeno y presión de dióxido de carbono transcutáneo) y monitorización neurológica (EEG, aEEG, saturación regional cerebral de oxígeno).
- Asistencia respiratoria que precise el paciente.
- Monitorización de la temperatura tanto central como periférica. Registro cada 15 minutos.
- Colocar al neonato dispositivo de enfriamiento (traje, colchón, casco). Iniciar tratamiento en modo servocontrolado. Alcanzar la temperatura diana en 20-30 minutos.
- Colaborar en la canalización, fijación y mantenimiento de la arteria y vena umbilical. Extracción de analítica de acceso umbilical. Monitorizar la presión arterial invasiva. Canalizar una vía venosa periférica, ya que tras la hipotermia terapéutica se produce una vasoconstricción.
- Realizar sondaje gástrico y vesical.
- Iniciar la administración de perfusiones y fármacos. Evitar variaciones rápidas en la volemia y en el flujo sanguíneo cerebral.
MANTENIMIENTO DE LA HIPOTERMIA (72 horas):
- Continuar cuidados relacionados con la monitorización de parámetros clínicos y neuromonitorización. Reconocimiento de trazado de fondo y presencia de convulsiones (aEEG).
- Control exhaustivo de la temperatura diana y gradiente, evitar variabilidad en la temperatura diana.
- Balance hidroelectrolítico horario, ya que una de las complicaciones de la hipotermia terapéutica es la oligoanuria por retención hídrica tisular.
- Vigilar patrón respiratorio, así como el aspecto de las secreciones; mantener normocapnia.
- Asegurar tensión arterial media > 45 mmHg.
- Realizar controles de glucemia cada 8 horas (objetivo: 70-100 mg/dL).
- Medir restos gástricos por turno, para detectar precozmente signos de disfunción gastrointestinal derivados del tratamiento.
- Vigilancia de la piel: al inicio del enfriamiento y cada tres horas mediante la escala e-NSRAS. Inspeccionar y documentar cambios en la coloración-perfusión de la piel, mucosas y puntos de apoyo. Evitar el apoyo de dispositivos de monitorización y tubuladuras del dispositivo respiratorio para evitar así la aparición de úlceras yatrogénicas. Valorar la presencia de nódulos indurados eritematosos, generalmente en prominencias óseas, signo de posible necrosis grasa del tejido subcutáneo.

RECALENTAMIENTO (6-12 horas) / NORMOTERMIA CONTROLADA (12-24 horas).
- Mantener la monitorización del paciente durante todo el proceso.
- Control exhaustivo de la temperatura diana: incrementar la temperatura corporal 0.2-0.5ºC cada hora, según tolerancia.
- Monitorizar al paciente mediante aEEG y NIRS: registrar la realización de cuidados, movimientos sugestivos de crisis y administración de fármacos (sedantes, analgésicos y anticonvulsivantes).
- Vigilar la aparición de posibles complicaciones: hipotensión, arritmias cardiacas, convulsiones clínicas y eléctricas.
- Al final del recalentamiento: normotermia controlada en cuna térmica, monitorización continua y registro horario de la temperatura central.
- No olvidar: es importante evitar la hipertermia durante todo el proceso, especialmente en la recuperación.
Durante el tratamiento con hipotermia terapéutica continuaremos brindando cuidados centrados en la familia, favoreciendo la escucha activa y la actitud empática e involucrando a los padres en los cuidados al recién nacido. Si en la fase de mantenimiento de la hipotermia terapéutica, el RN está estable hemodinámica, neurológica y respiratoriamente y no tiene convulsiones, ofrecer a los padres sostener en brazos al recién nacido, tras consenso de todo el equipo sanitario. Colocar una toalla o muselina entre el dispositivo de enfriamiento y los brazos de los progenitores.
4.4 DEFECTOS DEL TUBO NEURAL
Los defectos congénitos del tubo neural ocasionan malformaciones que afectan al desarrollo del sistema nervioso central.
El sistema nervioso central (cerebro y médula espinal) se forma en los embriones entre la tercera y la cuarta semana de gestación. Anteriormente, se ha formado el ectodermo, dando lugar a la placa neural, y posteriormente, al tubo neural al cerrarse. El momento en el que este proceso se ha visto alterado o interrumpido, va a condicionar los distintos tipos de defectos del tubo neural.
Dentro del mencionado proceso de formación del tubo neural aparecen dos mecanismos:
- Neurulación primaria: Consiste en la formación del tubo neural desde la región craneal hasta la región lumbar alta. Se produce entre la tercera y la cuarta semana de gestación.
- Neurulación secundaria: Consiste en la formación del tubo neural de la región lumbar baja y sacra.
4.4.1 Etiología
La Organización Mundial de la Salud (OMS) recomienda la ingesta de 400 microgramos de ácido fólico diario desde el momento en el que se planifica un embarazo hasta las 12 semanas de gestación, como prevención de los defectos del tubo neural. En mujeres con antecedentes o factores de riesgo la recomendación asciende a los 4 mg diarios.
Factores de riesgo:
- Factores ambientales como la contaminación ambiental o de los alimentos (insecticidas).
- Factores socioeconómicos.
- Factores de riesgo maternos: edad, paridad, obesidad, diabetes, drogas, medicación antineoplásica o anticonvulsiva, ingesta baja de folato, vitamina B12, zinc, etc.
- Predisposición genética.
- Agentes infecciosos.
4.4.2 Clasificación de los defectos del tubo neural
Esta clasificación va a determinar, en parte también, el pronóstico del recién nacido, ya que los niños con defectos cerrados suelen tener mejores resultados biológicos funcionales que los niños con defectos abiertos.
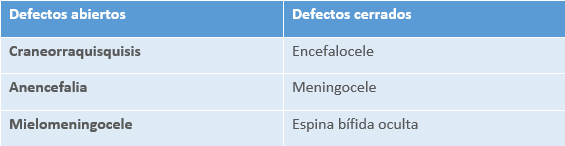
De estos, los más frecuentes son la anencefalia y la espina bífida. La anencefalia es una condición letal y generalmente va acompañada de la interrupción legal del embarazo.Dentro de la espina bífida encontramos la espina bífida oculta, el meningocele y el mielomeningocele.
- Espina bífida oculta: Es la forma más común, en donde una o más vértebras están malformadas y esta anomalía está cubierta por una fina capa de piel.
- Meningocele. Es una malformación congénita del tubo neural que se produce en la fase de neurulación secundaria. Se caracteriza por la abertura anómala de la columna vertebral, por lo general a la altura de L5 y S1, con protusión de las meninges que forma una lesión quística ocupada por líquido cefalorraquídeo sin elementos nerviosos en su interior, es decir, sin médula. Se halla protegida por epidermis normal que presenta un aspecto de piel hemangiomatosa, con “mechones de pelo”. Está asociada a déficits neurológicos.
- Mielomeningocele o espina bífida abierta. Es una forma más grave de espina bífida, ya que el defecto de la fusión del tubo neural se produce en la fase primaria de neurulación con compromiso de los elementos nerviosos, raíces y médula. Es frecuente en la región toracolumbar, lumbar y sacrolumbar. Existe un defecto óseo en el arco vertebral, a través del cual, se produce una hernia del saco meníngeo y la médula espinal. Puede estar cerrada o un poco abierta, lo que ocasiona un vaciamiento pequeño de líquido cefalorraquídeo. La mayoría de los casos de meningocele presenta cobertura incompleta de piel. Los déficits neurológicos que ocasiona están producidos por la exposición de la médula espinal durante el embarazo al líquido amniótico, que la va deteriorando, alterando su funcionalidad desde antes de nacer.
4.4.3 Mielomeningocele
Diagnóstico
El diagnóstico puede ser tanto prenatal como durante el nacimiento o después de él.
Los defectos abiertos, como el mielomeningocele, son detectables durante el embarazo, ya que se relacionan con concentraciones elevadas de alfafetoproteína y acetilcolinesterasa en el líquido amniótico, no siendo así en los defectos cerrados. También puede diagnosticarse mediante ecografía en el segundo trimestre de embarazo. Tras su diagnóstico, la interrupción del embarazo es legal en muchos países.
Tras el nacimiento, el diagnóstico se establece mediante:
- Examen físico completo, evaluación de la lesión y del compromiso neurológico, muscular y esquelético.
- Pruebas complementarias:
- Si la lesión fuera abierta, proceder al cultivo del líquido cefalorraquídeo.
- Radiografía de la columna vertebral.
- TAC.
- Resonancia magnética de la columna vertebral y cráneo.
- Ecografía renal y de las vías urinarias, uretrocistografía renal para evaluar malformaciones asociadas.
- Observación de las funciones vesical y anal, ya que casi todas las lesiones de esta naturaleza afectan a los nervios de la vejiga, produciendo vaciamiento incompleto de la vejiga y propensión tanto a incontinencia como a infección de las vías urinarias.
Tratamiento
El tratamiento convencional del mielomeningocele es la cirugía posnatal, realizada durante las primeras 48 horas de vida del recién nacido. Suele ser necesaria la colocación del shunt por hidrocefalia severa.
Sin embargo, existe evidencia de que la realización de la cirugía durante la vida fetal (entre las semanas 19 y 26 de embarazo) en algunos casos reduce la necesidad de shunt al hacer y mejora la función motora del recién nacido, ya que es conocido que el daño en la médula está relacionado con su exposición al líquido amniótico a lo largo de la gestación.
En general, el tratamiento del mielomeningocele requiere de un trabajo multidisciplinar y continuado en el tiempo.
Posibles manifestaciones clínicas y complicaciones
- Incontinencia de los esfínteres vesical y anal. Suelen producirse infecciones urinarias de repetición, que en ocasiones evolucionan a pielonefritis crónica.
- Flacidez muscular de los miembros inferiores, que condiciona dificultades en la movilidad y deambulación.
- Deformidades ortopédicas (pies zambos, escoliosis, subluxación de las caderas).
- Úlceras en miembros inferiores.
- Déficits sensoriales.
- Hidrocefalia asociada a malformación de Chiari II, presente en el 85-95% de los casos. Puede llegar a requerir derivación ventriculoperitoneal.
- Hidrocefalia secundaria al postoperatorio.
- Hipertensión intracraneal.
- Meningitis.
- Disfunción sexual.
- Trastornos respiratorios del sueño.
- Alergia al látex.
Cuidados de Enfermería en el preoperatorio
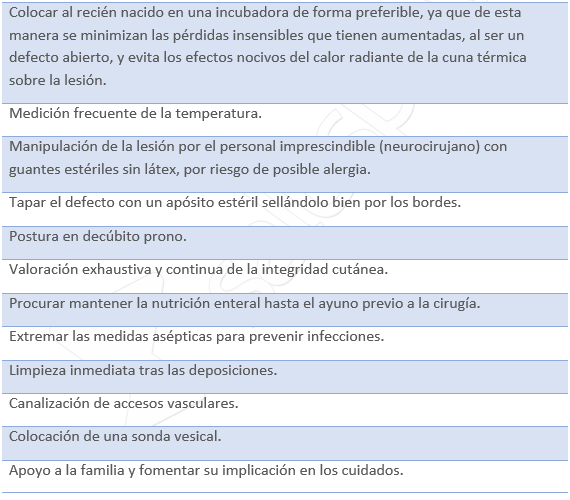
Cuidados postquirúrgicos

4.5 HIDROCEFALIA
La hidrocefalia consiste en un incremento patológico de líquido cefalorraquídeo en la cavidad craneal, resultado del aumento de la producción o disminución de la absorción de este. Como consecuencia, produce una dilatación de los ventrículos, espacios subaracnoideos y cisternas de la base, llevando a un aumento de la presión intracraneal, que afecta tanto al parénquima cerebral, como a los vasos sanguíneos.
Fisiología del líquido cefalorraquídeo
La mayor parte del líquido cefalorraquídeo (LCR) se produce en los plexos coroideos de los ventrículos laterales, con una producción aproximada de 500 ml por día en adultos. El LCR fluye desde los ventrículos laterales a través de los agujeros de Monro hacia el tercer ventrículo. Luego, pasa por el acueducto de Silvio hasta llegar al cuarto ventrículo, desde donde sale a través de los agujeros de Luschka y Magendie hacia la cisterna magna. Desde allí, el LCR se desplaza a las cisternas de la base y asciende hasta la convexidad craneal. La mayor parte del LCR se reabsorbe en los senos venosos durales, específicamente en las vellosidades aracnoideas.
Etiología y cuadro clínico
La causa más frecuente en el periodo neonatal de hidrocefalia es la obstructiva, bien por estenosis congénita del acueducto de Silvio o bien secundarias a hemorragias o infecciones. Las hidrocefalias posthemorrágicas se producen como consecuencia de hemorragias intraventriculares tanto en los recién nacidos prematuros como en los recién nacidos a término.
Otras causas son:
- Defectos del tubo neural: mielomeningocele.
- Tumores congénitos de mecanismo obstructivo.
- Síndromes con malformaciones del SNC como la malformación Arnold Chiari.
- Trisomías.
- Infecciones intrauterinas o meningitis (toxoplasma, varicela, sífilis, etc.)

4.5.1 Diagnóstico
El diagnóstico se establece a partir de:
- Ecografía en el periodo prenatal, si hubiera antecedentes de malformaciones.
- Medición del perímetro cefálico y observación de fontanelas y suturas.
- Evaluación de los signos clínicos.
- Ecografía transfontanelar (diagnóstico de elección).
- Resonancia magnética.
- Estudio angiográfico, en casos con malformaciones vasculares.
- TAC craneal, en casos urgentes con hipertensión intracraneal, para conocer la etiología de la hidrocefalia
4.5.2 Tratamiento
Por lo general, el tratamiento es quirúrgico y puede ser temporal o permanente:
- Temporal: Dispositivo de acceso ventricular que permita hacer extracciones puntuales de LCR o drenaje ventricular externo.
- Permanente: Colocación de un catéter que conduce el exceso de LCR desde los ventrículos laterales al peritoneo (derivación vetriculoperitoneal) o a la aurícula derecha (derivación ventriculoatrial) donde se absorbe.
El tratamiento quirúrgico precoz mejora la supervivencia y reduce el riesgo de retraso psicomotor a los dos años de edad.
4.5.2 Cuidados de Enfermería en la hidrocefalia
- Monitorización cardiorrespiratoria permanente, ya que la hidrocefalia produce inestabilidad de los parámetros vitales, causando apnea y bradicardia.
- Medición diaria del perímetro cefálico.
- Examen físico neurológico diario.
- Mantenimiento de la postura corporal anatómica, favorecer la flexión de miembros hacia la línea media. Cambio de decúbito cada 3-4 horas en función de la tolerancia del paciente, ya que, debido al aumento del peso del cráneo, es importante cambiar el decúbito y la posición para evitar úlceras o lesiones en la piel.
- Disminución de estresores ambientales.
- Ofrecer la alimentación en pequeñas tomas, ya que suelen tener cierta intolerancia alimenticia.
4.5.3 Intervenciones de Enfermería en el postoperatorio
- Medición diaria del perímetro cefálico, con el objetivo de evaluar la regresión o progresión de la hidrocefalia.
- Evaluación de la fontanela anterior. El abultamiento de la fontanela puede indicar funcionamiento inadecuado u obstrucción de válvula.
- Mantenimiento del decúbito lateral o dorsal para evitar presión en el lugar de la comunicación y evitar obstrucción del drenaje.
- Observación de signos clínicos de meningitis como vómito en chorro, hipertermia, irritabilidad, letargia, convulsiones y rigidez en la nuca.
- Observación de signos de peritonitis en los casos de las comunicaciones peritoneales como dolor a la palpación, distensión abdominal, hipertermia, taquicardia.
- Balance hídrico.
- Control del dolor.
- Si el sistema de derivación es externo, valorar la coloración del LCR, cantidad y lugar de incisión del catéter.
4.6 LESIONES CEREBRALES DEL RECIÉN NACIDO PREMATURO
El descenso de la mortalidad entre los recién nacidos prematuros, ha conllevado un incremento de la morbilidad neurológica a largo plazo: un 5-10% desarrollan parálisis cerebral y hasta un 25-50% presentarán alteraciones cognitivas en forma de trastornos del aprendizaje, alteraciones de la conducta y de la atención y déficits neurosensoriales.
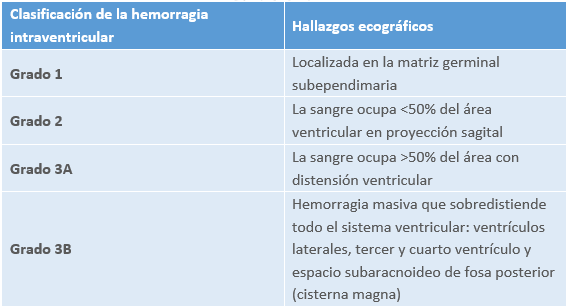
4.6.1 Hemorragia intraventricular
La hemorragia intraventricular constituye la complicación neurológica más importante en el recién nacido prematuro. A medida que aumenta la prematuridad del recién nacido, aumenta el riesgo de padecerla, de forma que puede llegar a aparecer hasta en un 70% de los recién nacidos menores de 700 gramos. Suele ocurrir durante las primeras 72 horas postparto, siendo excepcional su aparición a partir del tercer día.
Consiste en una lesión a nivel de la matriz germinal y las regiones periventriculares del cerebro provocada por la fragilidad de los vasos sanguíneos del cerebro del recién nacido, en la que intervienen de forma directa las fluctuaciones en el flujo cerebral por cambios hemodinámicos y otras alteraciones relacionadas con la coagulación sanguínea.
Se caracterizan por ser asintomáticas. Pueden producir cambios hemodinámicos y neurológicos cuando el sangrado es masivo.
El diagnóstico es mediante ecografía transfontanelar.
En cuanto al pronóstico, la hemorragia intraventricular por sí misma no suponen una alteración en el neurodesarrollo del niño. El pronóstico lo determina su asociación con otras patologías, como la ventriculomegalia posthemorrágica, el infarto hemorrágico periventricular o la leucomalacia periventricular.
4.6.2 Infarto hemorrágico periventricular
Se caracteriza por la necrosis hemorrágica de la sustancia blanca periventricular por isquemia secundaria a la obstrucción de las venas terminales adyacentes al ventrículo. Se presenta en el 15% de los prematuros de que desarrollan hemorragia intraventricular. Se asocian a hemorragias importantes (de un 80%)y suelen ocurrir en el mismo lado en el que la hemorragia intraventricular es mayor
La presentación clínica puede ser asintomática o acompañarse de un deterioro hemodinámico y neurológico súbito, al igual que en la hemorragia intraventricular.
El diagnóstico se realiza mediante ecografía transfontanelar. La localización más frecuente es frontoparietal y suelen ser grandes y unilaterales.
La importancia clínica de esta entidad radica en el pronóstico ya que se asocia a lesión motora permanente.
4.6.3 Leucomalacia periventricular
Se caracteriza por necrosis de la sustancia blanca periventricular dorsal y lateral. Se puede manifestar de dos maneras histológicamente diferenciables: como una necrosis focal con formación de quistes, o como una lesión difusa con pérdida de sustancia blanca e incremento del tamaño ventricular.
Dentro de los factores etiopatogénicos encontramos: fenómenos isquémicos en territorios de vascularización limítrofe, acción de citoquinas inflamatorias, etc.
El daño neuronal asociado a leucomalacia periventricular puede afectar a sustancia blanca, tálamo, ganglios de la base, corteza cerebral, tronco del encéfalo y cerebelo.
La presentación clínica, en fase aguda, es asintomática. Tras ello, pueden aparecer alteraciones del tono, temblores e hiperreflexia, siendo la principal secuela a largo plazo la diplejía espástica (con miembros inferiores más afectados). También se asocia a retraso cognitivo y déficits neurosensoriales.
4.6.4 Ventriculomegalia posthemorrágica
Afecta al 35% de los recién nacidos afectos de hemorragia intraventricular, iniciándose tras días o semanas. Se produce debido a una alteración en la circulación o reabsorción del líquido cefalorraquídeo. También puede ser por pérdida de sustancia blanca.
El cuadro clínico se relaciona con el aumento de la presión intracraneal, por lo que encontramos fontanela abombada, separación de suturas, aumento del perímetro cefálico y alteraciones del tronco cerebral.
El diagnóstico se realiza mediante ecografía transfontanelar.
En cuanto al pronóstico, el 60% de los casos de ventriculomegalia posthemorrágica se estabiliza sin necesidad de intervención; el 30% progresa lentamente a lo largo de las semanas y el 5% se detiene inicialmente para progresar de forma tardía a lo largo de los meses.
En casos de ventriculomegalia persistente o rápidamente progresiva, se establecerán medidas terapéuticas para resolver la dilatación en forma de punciones evacuadoras, drenaje ventricular externo o válvula de derivación ventrículo-peritoneal.
El pronóstico depende de la lesión de sustancia blanca asociada y posibles complicaciones de los dispositivos de evacuación.
4.7 ICTUS O INFARTO CEREBRAL PERINATAL
El ictus cerebral perinatal, que ocurre entre la semana 20 de gestación y los 28 días posnatales, se debe a una interrupción focal del flujo sanguíneo cerebral por embolización o trombosis.
Se clasifica en hemorrágico e isquémico, siendo este último el más común (70-90% de los casos). El ictus isquémico puede ser venoso (10%) o arterial (90%), y afecta principalmente a una de las principales arterias cerebrales.
La incidencia del ictus isquémico arterial perinatal (IIAP) es de 1 por cada 1.600 a 5.000 nacidos vivos y puede estar infradiagnosticado debido a la falta de síntomas evidentes. Su recurrencia es rara (<2%) en comparación con los ictus en edades pediátricas y adultas, y la mortalidad neonatal es significativamente menor. A pesar de su baja frecuencia y mortalidad, el IIAP causa morbilidad neurológica a largo plazo en el 65-75% de los casos, afectando la calidad de vida de los niños y generando una alta demanda de atención médica especializada.
Se trata de una condición multifactorial y compleja, con factores obstétricos y eventos intraparto aún poco comprendidos. El parto puede inducir un estado protrombótico, exacerbado por hipoxia-isquemia o infección-inflamación, y en muchos casos, existen factores de riesgo durante el parto. Las alteraciones de la coagulación se presentan en el 22,7% de los neonatos con IIAP.
Los síntomas suelen incluir convulsiones clónicas focales dentro de las primeras 36 horas de vida, aunque estas pueden pasar desapercibidas.
El diagnóstico temprano es crucial para evitar secuelas neurológicas significativas, como la hemiparesia y la parálisis cerebral infantil. La técnica diagnóstica de elección es la resonancia magnética.
Las secuelas neurológicas afectan al 63,6% de los niños, con un 41% desarrollando parálisis cerebral. Las diferencias en las secuelas varían según el hemisferio afectado, siendo más graves en el hemisferio izquierdo.
4.8 SÍNDROMES EPILÉPTICOS
4.8.1 Introducción
Las convulsiones neonatales son un importante indicador de disfunción neurológica en la primera infancia, aunque su reconocimiento puede ser complicado debido a la variabilidad en la presentación clínica, con muchas siendo subclínicas.
Las causas más comunes incluyen eventos hipóxicos-isquémicos, accidentes cerebrovasculares, hemorragias e infecciones.
Es crucial distinguir entre crisis convulsivas y episodios paroxísticos no epilépticos, los cuales se diferencian por sus características clínicas y respuesta a estímulos. La incidencia varía de 0,7 a 2,7 por cada 1000 nacidos vivos, siendo más alta en prematuros, con una mortalidad neonatal del 15-20%.
La morbilidad incluye riesgos significativos como epilepsia, parálisis cerebral, retraso del desarrollo y discapacidad intelectual, especialmente en los casos más severos, con un mayor riesgo de epilepsia posnatal durante el primer año de vida y una incidencia del 15-30% de parálisis cerebral entre los afectados.
4.8.2 Etiología
La determinación de la etiología de las convulsiones neonatales es crucial, ya que la causa subyacente determina el pronóstico y el tratamiento.
La encefalopatía hipóxico-isquémica debido a asfixia perinatal es la causa más frecuente (40-45%), seguida por accidentes cerebrovasculares isquémicos.
Otras causas frecuentes son:
- Las infecciones del SNC, como la meningitis bacteriana y viral.
- Alteraciones metabólicas como la hipoglucemia.
- Desequilibrios electrolíticos.
- Síndromes epilépticos neonatales genéticamente determinados, como las canalopatías.
- EHI y las hemorragias cerebrales: causas principales en prematuros.
- Eerrores congénitos del metabolismo.
Es esencial considerar antecedentes familiares de convulsiones y el uso de medicación materna durante el embarazo para una evaluación completa y precisa.
4.8.3 Manifestaciones clínicas
Las convulsiones neonatales clínicamente evidentes más comúnmente observadas son las convulsiones focales clónicas o focales tónicas. Estas convulsiones sintomáticas agudas no se generalizan al inicio clínico o electrográfico.
También pueden presentarse convulsiones clónicas multifocales, caracterizadas por movimientos clónicos simultáneos en todas las extremidades. En ocasiones, se pueden asociar cambios autonómicos paroxísticos con estas convulsiones.
Para un diagnóstico y cuantificación precisos de las convulsiones neonatales, se requiere la monitorización continua mediante EEG.
4.8.4 Clasificación de las crisis neonatales
La clasificación de las crisis neonatales según Mizrahi y la ILAE 2017 se divide en cuatro dominios: presentación clínica (eventos de alto riesgo o sospechosos clínicos), diagnóstico (con EEG), manifestación (con o sin manifestación clínica) y tipos de crisis con signos clínicos (motores: automatismos, clónicos, espasmos epilépticos, mioclónicos, secuenciales y tónicos; no motores: paro autonómico y conductual; y no clasificados) o sin signos clínicos (solo electrográfico).
Según el momento de inicio de las convulsiones
- Las crisis asociadas a la Encefalopatía Hipóxico-Isquémica ocurren en el primer día de vida.
- Las convulsiones en las primeras 72 horas postparto son predominantemente sintomáticas agudas, asociadas con accidente cerebrovascular, malformaciones cerebrales, meningitis bacteriana, infección intrauterina, VIH en recién nacidos prematuros, abstinencia de fármacos y errores congénitos del metabolismo (ECM).
- Las convulsiones después de la primera semana en neonatos por lo demás sanos pueden indicar un trastorno genético.
Según la semiología de las convulsiones:
- Las convulsiones mioclónicas sugieren un trastorno metabólico como hiperglicinemia no cetósica, deficiencia de sulfito oxidasa, acidemia propiónica y epilepsia dependiente de vitamina B6.
- Las convulsiones clónicas focales indican una lesión cortical focal como un accidente cerebrovascular, hemorragia intracraneal o displasia cortical.
- Las convulsiones tónicas pueden relacionarse con síndromes de epilepsia genética (KCNQ2, PEX, ARX, CDKL5, SPTAN, etc.).
- Los espasmos epilépticos son raros y se encuentran principalmente en ECM, malformaciones corticales o encefalopatías de inicio temprano.
- Muchas convulsiones neonatales asociadas a EHI son exclusivamente electrográficas.
4.8.5 Diagnóstico
Las crisis neonatales requieren una evaluación exhaustiva que combine la historia clínica detallada, un examen físico meticuloso y pruebas de laboratorio rápidas. Entre estas últimas, se incluyen la medición de glucosa en el punto de atención y la evaluación sistemática de infecciones, fundamentales para identificar la etiología en la mayoría de los casos.
Las pruebas complementarias deben ser dirigidas y se dividen en dos niveles. El primer nivel incluye pruebas analíticas, despistaje de infecciones, estudios metabólicos de primera línea, EEG y neuroimagen.
El EEG de amplitud integrada (EEGa) es una alternativa que simplifica la visualización en tiempo real, aunque no reemplaza al EEG debido a diferencias en sensibilidad. Durante la hipotermia terapéutica, se recomienda la monitorización EEG, así como durante el recalentamiento si es posible. La resonancia magnética (RM), especialmente la espectroscopia de resonancia magnética (ERM), es crucial para identificar lesiones estructurales y metabólicas en recién nacidos con convulsiones sintomáticas agudas.
Identificar convulsiones neonatales únicamente con observación clínica es desafiante, dado que muchas son subclínicas. Movimientos paroxísticos como mioclonías, movimientos focales, posturas tónicas y episodios autonómicos deben ser evaluados mediante EEG continuo para confirmar su naturaleza epiléptica. Las mioclonías neonatales benignas del sueño, en particular, son episodios rítmicos durante el sueño con EEG normal y suelen resolver antes de los seis meses de edad.
Este enfoque integrado es crucial para un diagnóstico preciso y un manejo efectivo de las crisis neonatales.
4.8.6 Tratamiento
Las crisis neonatales pueden estar frecuentemente asociadas a trastornos metabólicos, hidroelectrolíticos o infecciosos, por lo que es crucial identificar y corregir estas causas adecuadamente.
- La hipoglucemia se define como niveles por debajo de 40 mg/dl durante las primeras 72 horas de vida y por debajo de 60 mg/dl posteriormente.
- Las alteraciones electrolíticas incluyen hipocalcemia precoz y tardía (calcio total < 7 mg/dl o calcio iónico < 1 mg/dl), hipomagnesemia (< 1 mEq/l), y desequilibrios en los niveles de sodio (< 120 mEq/l para hiponatremia, > 150 mEq/l para hipernatremia).
- Entre las causas infecciosas se encuentran bacterias como Streptococcus del grupo B y E. coli, además de infecciones virales como la toxoplasmosis y encefalitis por virus herpes simple, coxsackie o citomegalovirus (ver Figura 1).
Si bien se recomienda esperar la confirmación mediante EEG antes de iniciar el tratamiento en neonatos con crisis, hay situaciones específicas donde es imperativo iniciar la terapia de forma inmediata. Esto incluye casos sospechosos de encefalopatía o cuando las crisis son persistentes, como las focales repetitivas.
El fenobarbital sigue siendo el fármaco de primera línea más utilizado actualmente, aunque genera controversia debido a posibles efectos secundarios como sedación, apoptosis neuronal en modelos animales y trastornos de memoria a largo plazo. Su efectividad es del 50%, administrado a dosis de 20 mg/kg. Sin embargo, pacientes con ictus hemorrágico o prematuros extremos pueden tener una respuesta menos favorable al fenobarbital. En estos casos, el pronóstico neurológico tiende a ser peor, con menor control de las crisis y más alteraciones en la resonancia magnética cerebral.
El levetiracetam se plantea como una alternativa prometedora al fenobarbital, con presentación oral e intravenosa y un perfil de seguridad establecido en niños mayores. A pesar de esto, se necesitan más estudios para confirmar su eficacia y seguridad en neonatos. En situaciones de estatus refractario o EEG severamente alterado, se considera la administración de piridoxal 5 fosfato, biotina y ácido folínico como opciones adicionales.
La fenitoína intravenosa tiene una eficacia similar al fenobarbital, pero su farmacocinética es impredecible en neonatos y puede causar efectos adversos como hipotensión y arritmias cardíacas, relegándola a una posición de segunda o tercera línea.
Aproximadamente el 66% de los pacientes con crisis tendrán una respuesta incompleta a los tratamientos mencionados. No existe consenso claro sobre la superioridad de un tratamiento sobre otro y las prácticas varían significativamente entre centros. En casos de crisis resistentes o estatus convulsivo, el midazolam administrado por perfusión continua es una opción extendida.
Respecto a la duración del tratamiento, en casos de crisis agudas sintomáticas no hay un protocolo universalmente aceptado, aunque se suele simplificar al alta (idealmente con uno o dos fármacos) y retirar gradualmente en días o semanas. En pacientes con epilepsia de origen metabólico, puede ser necesario el uso continuado de cofactores. Algunos pacientes pueden beneficiarse de terapias dietéticas, como en el caso de la hiperglicinemia no cetósica.
En los niños con epilepsia asociada a los genes KCNQ2 y KCNQ3, se recomienda un manejo precoz con fármacos bloqueantes del calcio como carbamazepina u oxcarbazepina. Estos pacientes presentan síntomas característicos como crisis tónicas, clónicas de extremidades y cambios en el patrón respiratorio o frecuencia cardíaca, con posibles hallazgos en EEG como paroxismo-supresión o registro intercrítico normal.
4.9 PATOLOGÍA INFECCIOSA: MENINGITIS NEONATAL
4.9.1 Introducción
La meningitis neonatal se diagnostica por signos y síntomas de infección sistémica, marcadores inflamatorios y alteraciones en el líquido cefalorraquídeo (LCR), sin necesidad de aislar microorganismos. Los parámetros normales del LCR varían según la edad gestacional y el estado de prematuridad del recién nacido. La meningitis se clasifica en microbiológicamente probada, probable y no probada, según los resultados de los cultivos de LCR y hemocultivos. La causa de por qué algunos recién nacidos con bacteriemia desarrollan meningitis y otros no, no está clara, aunque se relaciona con la cantidad de bacterias en la sangre y sus características, como el antígeno capsular de E. Coli.
Las meningitis neonatales se clasifican en precoces y tardías según la edad de inicio de los síntomas. Las precoces (primeros 3-7 días) suelen ser de transmisión vertical desde la madre, mientras que las tardías (después de 4-7 días) suelen ser de origen nosocomial o comunitario. Sin embargo, la clasificación basada en el mecanismo de transmisión (vertical o nosocomial/comunitaria) es más adecuada. Se considera transmisión vertical cuando los síntomas aparecen en los primeros tres días de vida con factores de riesgo maternos, y transmisión nosocomial cuando los síntomas aparecen después de las 72 horas sin factores de riesgo verticales.
4.9.2 Meningitis vertical
La meningitis neonatal de transmisión vertical es causada por gérmenes ubicados en el canal genital materno que contaminan al feto durante el parto. Los factores de riesgo incluyen:
- Colonización vaginal materna por patógenos.
- Parto prematuro espontáneo.
- Corioamnionitis.
- Fiebre intraparto.
- Rotura prolongada de membranas.
- Hipoxia.
- Infección urinaria al final de la gestación.
Etiología
Los patógenos más comunes en la meningitis precoz son:
- Streptococcus agalactiae.
- Escherichia coli (E. coli).
- Listeria monocytogenes.
Clínica
Los síntomas suelen aparecer en los primeros tres días de vida y pueden incluir:
- Distermia (fiebre o hipotermia).
- Irritabilidad.
- Llanto quejumbroso.
- Apatía.
- Crisis convulsivas.
- Fontanela tensa.
Diagnóstico
El diagnóstico se basa en:
- Sintomatología sugestiva.
- Alteraciones en el hemograma.
- Elevación de reactantes de fase aguda (PCR, PCT, IL-6).
- Hallazgos en el LCR indicativos de meningitis.
Tratamiento
Se recomienda iniciar tratamiento antibiótico empírico mientras se esperan los resultados microbiológicos. El tratamiento incluye:
- Ampicilina a dosis doble que en la sepsis.
- Cefalosporina de tercera generación (especialmente cefotaxima) por su mejor difusión en el LCR.
Ajustes basados en la sensibilidad y resistencia del germen identificado, como la combinación de ampicilina y gentamicina en el caso de Listeria monocytogenes.
Complicaciones y mortalidad
Las complicaciones agudas pueden incluir:
- Edema cerebral.
- Hipertensión intracraneal progresiva.
- Lesión cerebral parenquimatosa difusa o focal.
- Ventriculitis.
El diagnóstico de estas complicaciones se realiza mediante ecografía cerebral, TAC y EEG. La mortalidad oscila entre 10-35%, siendo mayor en recién nacidos de muy bajo peso. La presencia de convulsiones es un factor de mal pronóstico, multiplicando por seis el riesgo de secuelas.
4.9.3 Meningitis nosocomial
Las meningitis nosocomiales en neonatos son causadas por gérmenes presentes en el entorno hospitalario, especialmente en la UCI neonatal. Estos gérmenes primero colonizan la piel y/o mucosas del recién nacido, atraviesan la barrera cutáneo-mucosa, invaden el torrente sanguíneo y finalmente cruzan la barrera hematoencefálica, causando meningitis. Los factores de riesgo para esta condición incluyen la estancia en la UCI neonatal, prematuridad, uso previo de antibióticos de amplio espectro, empleo de catéteres centrales para la alimentación intravenosa, intubación traqueal y ventilación mecánica, así como anomalías congénitas y procedimientos neuroquirúrgicos.
Etiología
Los microorganismos responsables incluyen bacterias Gram-positivas y Gram-negativas.
- Staphylococcus epidermidis.
- E. coli.
Clínica y Diagnóstico
La sintomatología de la meningitis nosocomial es similar a la de la sepsis y generalmente se inicia en la segunda semana de vida. Los síntomas más comunes incluyen irritabilidad, llanto quejumbroso, apatía, distermia, vómitos y síntomas respiratorios. La fontanela tensa y las convulsiones se presentaron en un menor porcentaje de casos. El diagnóstico se basa en la presencia de clínica sugestiva, hemograma alterado, elevación de reactantes de fase aguda y alteraciones en el LCR. La coincidencia entre hemocultivo y el aislamiento del patógeno en el LCR fue del 55%.
Tratamiento
El tratamiento antibiótico empírico recomendado incluye la combinación de ampicilina a dosis doble y una cefalosporina de tercera generación, como cefotaxima, debido a su mejor difusión en el LCR. En neonatos prematuros con catéter invasivo, se sugiere el uso de cefotaxima junto con vancomicina o teicoplanina. En meningitis por Candida, se recomienda anfotericina B y flucitosina. El tratamiento de soporte incluye manejo de fluidos, inotrópicos, ventilación mecánica si es necesario, anticonvulsivantes y manejo del edema cerebral e hidrocefalia.
Complicaciones y Mortalidad
Las complicaciones incluyen edema cerebral, hipertensión intracraneal, lesiones cerebrales parenquimatosas y ventriculitis. La presencia de convulsiones se asoció a un mal pronóstico, incrementando el riesgo de mortalidad y secuelas.
4.10 PLAN DE CUIDADOS AL PACIENTE NEONATAL CON PATOLOGÍA NEUROLÓGICA
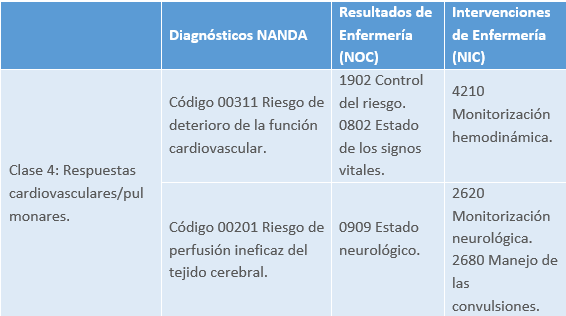
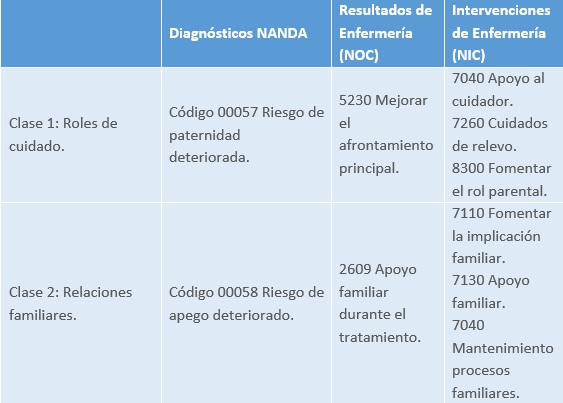
Valoración por patrones funcionales de Margory Gordon
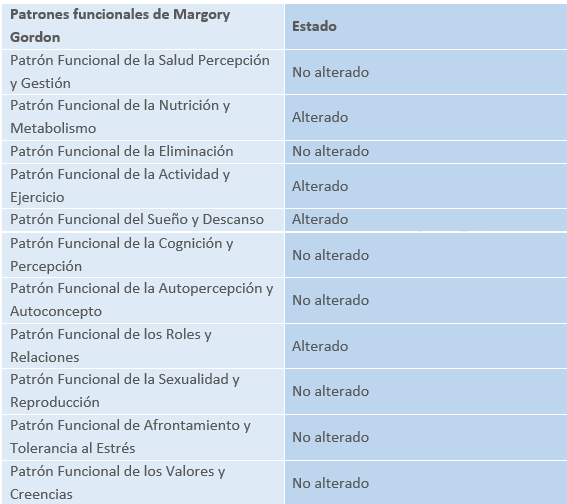
Patrón funcional de la nutrición y metabolismo
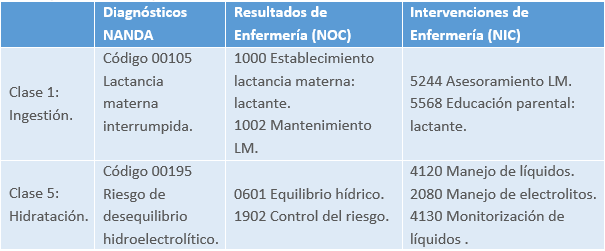
Patrón funcional de la actividad y ejercicio.
Patrón funcional de los roles y relaciones.
BIBLIOGRAFÍA
- Pérez Rodríguez J, Cabrera Lafuente M, Sanchez Torres AM. Apnea en el periodo neonatal. Servicio de Neonatología, Hospital Universitario la Paz; Departamento de Pediatría, Universidad Autónoma de Madrid. Asociación Española de Pediatría. Protocolos actualizados 2008. Disponible en: www.aeped.es/protocolos.
- Canals Candela FJ, González Gimeno C, García Gimeno N, López Pérez E, Echeverría Alcolea JJ. Terapia con surfactante con técnica mínimamente invasiva: experiencia en un hospital terciario. An Pediatr (Barc). 2016;84(2):79-84.
- Castillo Salinas F, García-Muñoz Rodrigo F, García-Alix Pérez A, Vento Torres M. Recomendaciones para la asistencia respiratoria en el recién nacido (III). Surfactante y óxido nítrico. An Pediatr (Barc). 2015;83(5):354.e1-354.e6.
- Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M, Amin H. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2017;102(1)
- Hipoplasia pulmonar infantil. An Pediatr (Barc). 2007;67(1):78-86.
- Balboa de Paz F, Rueda Esteban S, Paredes Mercado C, Barbosa Gomes E. Neumonías neonatales. Acta Pediatr Esp. 2008;66(10):481-486.
- Iriondo Sanz M, Burón Martínez E, Thió Lluch M, Aguayo Maldonado J, Salguero García E, Fernández Lorenzo JR, et al.; Grupo Español de Reanimación Neonatal de la Sociedad Española de Neonatología. Reanimación neonatal. Asociación Española de Pediatría. Protocolos actualizados 2008. Disponible en: www.aeped.es/protocolos.
- Nascimento Tamez R, Jones Pantoja Silva M. Enfermería en la Unidad de Cuidados Intensivos Neonatal: Asistencia del recién nacido de alto riesgo. 1ª ed. 31 de Mayo 2022. Ed. Panamericana.
- Bazo Hernández L, Llorca Porcar A, Padró Hernández M. Neonatología para Enfermería. 1ª ed. Madrid: Editorial Panamericana; 2024.
- González Brabin A, García Teresa MA, García-Salido A. Oxigenoterapia. Pediatr Integral. 2021;25(1):37-43.
- Vicente S. Cuidados posturales del recién nacido pretérmino en UCI neonatal de “Hospital de la Santa Creu I Sant Pau” Barcelona. Desenvolupa.net [Internet]. 2011. Disponible en: http://www.desenvolupa.net/Ultims-Numeros/Numero-33-05-2012/Cuidados-posturales-del-recien-nacido-pretermino-en-UCI-neonatal-de-Hospital-de-la-Santa-Creu-i-Sant-Pau-Barcelona-S.-Vicente
- López M, et al. Manual de procedimientos de enfermería en las unidades neonatales. Bogotá: Alcaldía Mayor de Bogotá; p. 33-5.
- Posturas de los bebés prematuros para un desarrollo fisiológico óptimo. Best Practice [Internet]. 2010;1-4. Disponible en: https://www.evidenciaencuidados.es/BPIS/PDF/2010_14_18_BestPrac.pdf
- Prego R, et al. Protocolo de cuidados centrados en el desarrollo. 1ra ed. Sistema de Xestión de Calidad de Unidad de Neonatología; 2010. p. 6-8.
- Solari B, Pavlov N. Síndrome apneico en el recién nacido prematuro. Rev Neurol. 2013;24(3):396-402. doi: 10.1016/S0716-8640(13)70175-5.
- Coto Cotallo GD, López Sastre J, Fernández Colomer B, Álvarez Caro F, Ibáñez Fernández A. Recién nacido a término con dificultad respiratoria: enfoque diagnóstico y terapéutico. Asociación Española de Pediatría; 2008. [citado en 2023]. Disponible en: www.aeped.es/protocolos.
- Bautista-Hernández V. Tetralogía de Fallot con estenosis pulmonar: aspectos novedosos. Embriología básica cardiaca. 2021.
- Romera G, Zunzunegui JL. Recién nacido con sospecha de cardiopatía congénita. Asociación Española de Pediatría; 2008. [citado en 2023]. Disponible en: www.aeped.es/protocolos/.
- Ruiz González MD, Gómez Guzmán E, Párraga Quiles MJ, Tejero MA, Guzmán Cabañas JM. Ductus arterioso persistente. Asociación Española de Pediatría; 2008. [citado en 2023]. Disponible en: www.aeped.es/protocolos/.
- Centella Hernández T, Stanescu D, Stanescu S. Atresia pulmonar con comunicación interventricular. Circ Vasc. 2014;21(2):132-7. doi: 10.1016/j.circv.2014.02.003.
- Moliner Calderón E, Álvarez Pérez R, Ginovart Galiana G. Insuficiencia cardiaca en el recién nacido. Unidad de Neonatología. Servicio de Pediatría. Hospital de la Santa Creu i Sant Pau. Barcelona. Asociación Española de Pediatría; 2008.
- Valverde E, García-Alix A, Blanco D. Monitorización continua de la función cerebral mediante electroencefalografía integrada de amplitud. An Pediatr. 2008;6(3):169-73. doi: 10.1016/S1696-2818(08)74873-X.
- Castro López F, Urbina Laza O. Manual de enfermería en neonatología. La Habana: Maura E. Díaz Antúnez; 2007. p. 58-61.
- Quero J, García-Alix A. Reflejos primitivos o del desarrollo. En: Evaluación neurológica del recién nacido. Madrid: Diaz de Santos; 2012. p. 839-71.
- Aguilar Cordero M. Tratado de enfermería infantil. Cuidados pediátricos. Madrid: ELSEVIER; 2021. p. 39-51.
- Cancho Candela R. Detección de alteraciones en el desarrollo psicomotor en infancia temprana. En: AEPap ed. Curso de Actualización Pediatría 2008. Madrid: Exlibris Ediciones; 2008. p. 253-60.
- Ibáñez S, Lara Herguedas J. Crisis neonatales. Protoc diagn ter pediatr. 2022;1:387-97.
- Fernández Colomer B, López Sastre J, Coto Cotallo GD, Ramos Aparicio A, Ibáñez Fernández A. Meningitis neonatal. Servicio de Neonatología, Hospital Universitario Central de Asturias. Asociación Española de Pediatría; 2008.
- Arias-Llorente RP, Lareu-Vidal S, González-Sánchez S, Blanco-Lago R. Serie de 22 casos de ictus isquémico arterial perinatal: factores de riesgo, manejo clínico y secuelas neurológicas. Rev Neurol. 2023;77:151-8. doi: 10.33588/rn.7707.2023158. PMID: 37750545.
- Luna Aljama J. Cuidados de enfermería en el niño con hidrocefalia. H.U. Reina Sofía de Córdoba; 2016 Sep 10.
- Moreno Mendieta M, Núñez Enamorado N. Hidrocefalia en pediatría. Protoc diagn ter pediatr. 2022;1:145-50.
- Blanco D, García-Alix A, Valverde E, Tenorio V, Vento M, Cabañas F. Neuroprotección con hipotermia en el recién nacido con encefalopatía hipóxico-isquémica. Guía de estándares para su aplicación clínica. An Pediatr (Barc). 2011;75(5):341.e1-341.e20. Disponible en: www.elsevier.es/anpediatr.
- Clemente León M. Hipertiroidismo en el embarazo. Recién nacido hijo de madre con enfermedad de Graves. Rev Esp Endocrinol Pediatr. 2014;5 Suppl(2):35-40. doi: 10.3266.
- Ares Segura S, Temboury Molina C, Chueca Guindulain MJ, Grau Bolado G, Alija Merillas MJ, Caimari Jaume M, Casano Sancho P, Moreno Navarro JC, Rial Rodríguez J, Rodríguez Sánchez A. Recomendaciones para el diagnóstico y seguimiento del feto y del recién nacido hijo de madre con patología tiroidea autoinmune. An Pediatr (Barc). 2018;89(4):254.e1-254.e7. doi: 10.1016/j.anpedi.2018.07.006.
