4.1 INTRODUCCIÓN
4.1.1 Equilibrio hidroelectrolítico
El equilibrio hidroelectrolítico es fundamental para la homeostasis corporal y se refiere a la relativa constancia de la distribución de agua e iones en los tres compartimentos corporales: interior celular, espacio intersticial y vasos sanguíneos.
El mecanismo de homeostasis de la placenta regula este equilibrio hidroelectrolítico en el feto hasta el nacimiento, momento en el que debe comenzar la autorregulación del recién nacido al tener que adaptarse a la vida extrauterina. Este equilibrio se mantiene en condiciones normales gracias a las llamadas Fuerzas de Starling que desplazan líquidos a través de la membrana celular.
El recién nacido prematuro tiene un exceso de agua corporal los primeros días de vida, debido a su sistema inmaduro para promover la estabilidad hidroelectrolítica necesaria, tiene un flujo urinario lento, que provoca una orina más diluida y balance hídrico negativo. Por eso, en la primera semana de vida, puede llegar perder hasta un 15% del peso corporal, aunque lo más normal es que la pérdida oscile entre un 5% y un 10%.
Esta pérdida de peso en forma de agua, no se produce solo a través de la orina, sino también en las heces o a través de pérdidas insensibles, por vía transepidérmica y por la respiración.
En cuanto a la orina, es importante identificar el número y apariencia de las micciones del neonato, sabiendo que al 92 % de ellos orina por primera vez en las primeras 24h, y el 99% antes de las 48h de vida, aunque puede haber un retraso por disminución de la volemia, por ejemplo, a causa de una hemorragia.
La tasa de eliminación de orina va a depender de la función renal, de la edad gestacional y de episodios que hayan podido ocurrir en el periodo perinatal, además de los líquidos recibidos después del nacimiento, pero de forma general podemos decir que la diuresis normal en el recién nacido varía entre 1 y 3 ml/kg/h.
4.1.1.1 Movimiento de líquidos. Fuerzas de Starling
Las fuerzas de Starling, mencionadas con anterioridad, determinan el movimiento de líquidos entre los capilares y el espacio intersticial (el espacio entre las células). El equilibrio entre estas fuerzas determina si el líquido se filtra hacia fuera de los capilares o se reabsorbe hacia dentro de ellos. Estas fuerzas son:
- Presiones hidrostáticas: Fuerza de empuje que ejerce directamente el agua sobre una superficie.
- Presión Hidrostática capilar (PC): Es la presión que ejerce el plasma sobre el capilar generando una tendencia a la filtración del líquido desde el capilar hacia el intersticio.
- Presión hidrostática intersticial (PI): Sería la fuerza que tiene el agua acumulada en el intersticio y tiende a empujar el líquido de regreso al capilar, por lo que podemos decir que actúa como fuerza de Reabsorción.
- Presiones osmóticas/coloidosmóticas: Esta fuerza la ejercen las proteínas (principalmente la albúmina), generando una succión hacia los capilares (impidiendo así la salida del líquido en los vasos hacia el espacio intersticial).
- Presión oncótica/osmótica del plasma (PCP): generada por las proteínas del plasma, principalmente la albúmina, generando una tendencia de reabsorción de líquido desde el intersticio al capilar.
- Presión oncótica intersticial (POI): fuerza de succión que tiende a filtrar líquido desde el plasma al intersticio provocado por las proteínas que se encuentran en el intersticio (en condiciones fisiológicas no debe haber proteínas en el líquido intersticial, por lo que su valor 0, aunque puede verse aumentado en condiciones patológicas.
A modo de resumen, la presión de los capilares tiende continuamente a impulsar líquido y sustancias disueltas a través de sus poros hacia los espacios intersticiales.
Por el contrario, la presión osmótica ejercida por las proteínas plasmáticas (presión coloidosmótica) tiende a causar un desplazamiento líquido por ósmosis desde los espacios intersticiales hacia la sangre.
A modo de resumen: Si la presión hidrostática capilar es mayor que la presión oncótica capilar, el líquido se filtra hacia los tejidos. Si la presión oncótica capilar es mayor, el líquido se reabsorbe hacia los capilares.
4.1.2 Aparato renal
En relación al mantenimiento de la homeostasis, vamos a ver el aparato renal como uno de los más directamente implicados, sus funciones básicas son: regulación del volumen de líquidos y electrolitos, regulación del equilibrio ácido-base y excreción de productos de desecho metabólico, regulación de la tensión arterial, estimulación de la síntesis de eritrocitos y en la formación de los metabolitos activos de la vitamina D.

4.1.2.1 Anatomía del aparato urinario
1. Riñones:
Tienen forma de judía, con dos caras, una anterior y otra posterior, un borde externo convexo y un borde interno cóncavo, en el que está situado el hilio renal por donde van a entrar y salir las arterias y las venas renales, los vasos linfáticos y la pelvis renal.
Normalmente el riñón izquierdo es más voluminoso y suele estar más elevado, ya que el riñón derecho está desplazado por el hígado.
Encima de cada riñón hay unas formaciones glandulares (glándulas suprarrenales) que se sitúan en los polos superiores.
En el riñón se pueden estudiar dos tipos de estructuras: La estructura macroscópica, que se observa a simple vista, realizando un corte longitudinal de un riñón y la estructura microscópica, que se observa al microscopio, y donde se estudia la nefrona.
2. Nefrona:
La nefrona es la unidad funcional y estructural del riñón. Cada riñón contiene aproximadamente 1,2 millones de nefronas capaces de producir orina.
Cada nefrona está formada por un corpúsculo renal o corpúsculo de Malpighi en el que se diferencian el glomérulo y la cápsula de Bowman y un sistema tubular donde se distinguen el túbulo contorneado proximal, el asa de Henle, el túbulo contorneado distal y el túbulo colector:
Región glomerular: Filtración
- Glomérulo: Es el “filtro” de la nefrona. Produce la ultrafiltración del plasma, originando el filtrado glomerular.
- Cápsula de Bowman: recoge el filtrado y se dirige a los túbulos.
La tasa de filtración glomerular de los recién nacidos, sobre todo si son prematuros, es baja, al ser baja la presión arterial media, la resistencia vascular renal alta y la nefrogénesis incompleta hasta las 34 semanas. Debido a esa baja tasa de filtración glomerular, los recién nacidos tienen dificultad en excretar volumen. Al aumentar el flujo de sangre renal, eleva la tasa de filtración glomerular. Esta tasa se evalúa por medio de los valores de laboratorio de la depuración de la creatinina y la insulina.
Región tubular: Modificación del volumen y composición del filtrado mediante los procesos de reabsorción y secreción.
- Túbulo contorneado proximal (TCP): Reabsorbe entre el 60 y 70% del volumen filtrado y de nutrientes como aminoácidos glucosa, sodio o potasio.
- Asa de Henle: Tienen como funciones la reabsorción de sodio y cloro y cierta absorción de agua.
- Túbulo contorneado distal (TCD): Cumplen funciones de reabsorción de agua en respuesta a la hormona antidiurética, secreción de potasio y reabsorción final de sodio en respuesta a la aldosterona. También reabsorben cloro y bicarbonato, y eliminan hidrógeno iónico. En los neonatos, la función del túbulo distal está disminuida, lo que conlleva a la incapacidad de concentrar la orina, a la pérdida de sodio y a la disminución de la secreción de potasio.
- Túbulo colector: donde converge el fluido de varias nefronas y de donde la orina accede a la pelvis renal.
Entre estos elementos se establecen capilares peritubulares y venas.

Imagen 08. Fuente: Salusplay
3. Uréteres
Son dos tubos de pequeño diámetro, que llevan la orina desde la pelvis hasta parte posterior de la vejiga. Al entrar en la vejiga, lo hacen de manera oblicua, de forma que se impide el retroceso de la orina durante la contracción vesical (como si de un sistema valvular se tratara).
Durante su descenso, el uréter se contrae (ondas peristálticas) para garantizar el avance de la orina.
4. Vejiga
Es una bolsa plegable localizada justo por detrás de la sínfisis del pubis y encargada del almacenaje de la orina. Se encuentra por debajo del peritoneo parietal, que cubre solo la parte superior. La pared de la vejiga es músculo liso, sus fibras se disponen en múltiples direcciones y otorgan a la vejiga una gran facultad de contracción y dilatación.
En el suelo de la vejiga, encontramos 3 orificios 2 de los uréteres y 1 que comunica con la uretra. Los orificios de los uréteres están en los ángulos posteriores del suelo, ubicados de forma triangular (conforman así el trígono), y el orificio uretral, en el ángulo anterior e inferior.
5. Uretra
Es un tubo de escasa longitud que comunica el suelo de la vejiga con el exterior. En su inicio, a la salida de la vejiga, se encuentra el esfínter uretral externo, de musculatura estriada. Al final de su recorrido, se observa un orificio de evacuación de la orina denominado meato urinario.

Imagen 09.Fuente: Salusplay
4.1.2.2 Formación de la orina
Las regiones glomerular y tubular de la nefrona son las encargadas de la formación de la orina. Esto se consigue con la “limpieza” o “aclarado” del plasma mediante tres mecanismos: Filtración, reabsorción y secreción.
- Filtración: en primer lugar, la sangre llega a través de la arteriola aferente a la nefrona. Esta se ramifica en la red capilar glomerular, la cual, gracias a su alta presión, permite que se filtren líquido y iones hacia la cápsula de Bowman.
- El filtrado glomerular es la cantidad de líquido que pasa a través de la pared del capilar glomerular hacia el espacio urinario de Bowman por unidad de tiempo. Para su cálculo se emplea una sustancia estable en sangre, la creatinina. La medición de la tasa del filtrado glomerular aporta valiosa información sobre la funcionalidad del riñón.
- Reabsorción: Una vez que el filtrado llega a la cápsula de Bowman, sigue el siguiente recorrido: túbulo proximal àasa de Henle àtúbulo distal àtúbulo colector àpelvis renal.
- Más del 99 % del agua del filtrado es absorbida por ósmosis en este trayecto, junto con numerosos iones, por mecanismos de transporte activo y pasivo.
- Secreción: las células tubulares tienen la capacidad de secretar algunas sustancias (potasio, hidrogeniones o amoniaco, entre otras, e incluso algunos fármacos como la penicilina) al interior de los túbulos, de manera que contribuyen a la composición de la orina.
A continuación, se exponen algunos términos en relación con el sistema renal, con el fin de facilitar el estudio de esta parte de la asignatura:

4.1.2.3 Papel del riñón en la regulación de la presión arterial
A modo genérico, podemos aceptar que la volemia total condiciona la tensión arterial de modo directamente proporcional: a mayor volemia, mayor tensión arterial. Así, las funciones del riñón irán encaminadas a regular la volemia total, aumentando o disminuyendo diuresis.
Sin embargo, estos mecanismos no son inmediatos, sino que están mediados por una serie de hormonas, a destacar:
- Hormona antidiurética o vasopresina (ADH - AVP)
- Sistema renina - angiotensina - aldosterona (SRAA)
- Péptido natriurético atrial (PNA)
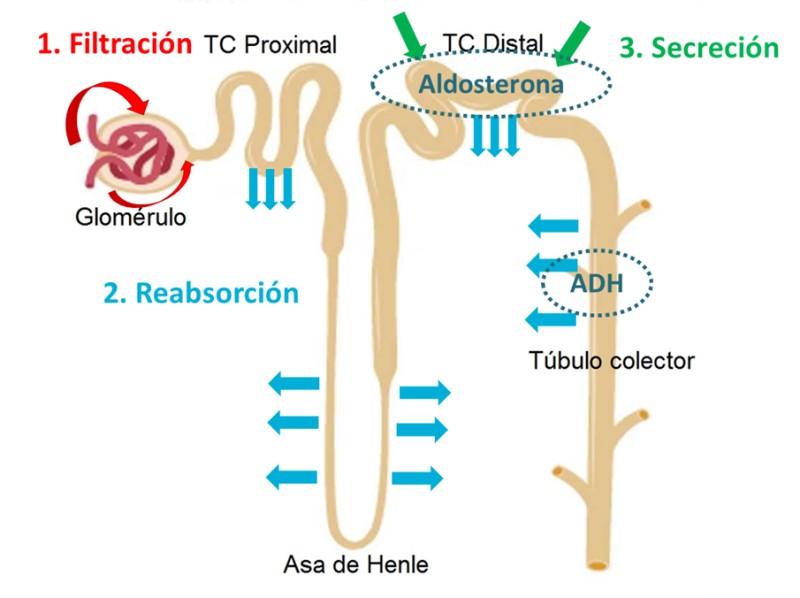
Imagen 10. Fuente: Salusplay
- Hormona antidiurética o vasopresina: estimula la reabsorción de agua a nivel del túbulo colector, facilitando la concentración de la orina. También es capaz de aumentar la tensión arterial con ciertos efectos vasoconstrictores.
- Sistema renina-angiotensina-aldosterona (SRAA): es uno de los sistemas fisiológicos más importantes del organismo, pues desempeña un papel fundamental en la regulación del volumen sanguíneo y la resistencia vascular sistémica. Así pues, su principal función es la regulación de la presión arterial. Esto tiene especial importancia en situaciones de hemorragias, por ejemplo.
Componentes:
- Renina
- Angiotensina
- Aldosterona.
El hígado produce continuamente una molécula de elevado peso molecular, el angiotensinógeno, que llega al riñón por vía sanguínea. Este se encarga de la producción de renina, una proteína que activa al angiotensinógeno y lo transforma en angiotensina I. Esta última es inactiva metabólicamente hablando, hasta que alcanza el pulmón y, por la hormona convertidora de angiotensina (una diana muy importante en el tratamiento farmacológico de la presión arterial), se transforma en angiotensina II.
Angiotensinógeno (por efecto de la renina) → angiotensina I (molécula inactiva) → angiotensina II (molécula activa)

Imagen 11. Fuente: Salusplay
- Péptido natriurético atrial: es una hormona liberada por las células del atrio del corazón en respuesta al estiramiento de las paredes atriales, que ocurre, por ejemplo, durante un aumento en el volumen sanguíneo. Actúa sobre los riñones para aumentar la excreción de sodio y agua, lo que resulta en natriuresis (eliminación de sodio) y diuresis (eliminación de agua). Esta acción contribuye a reducir el volumen sanguíneo y la presión arterial. Pero, además, participa de forma significativa en la vasodilatación, suprimiendo tanto el SRAA como la secreción de ADH, al tiempo que actúa como vasodilatador sobre el endotelio de los vasos.
4.1.2.4 Equilibrio ácido base
El pH se define como el logaritmo negativo de la concentración de hidrogeniones y viene a indicar el grado de acidez y alcalinidad de una solución.
Los valores de pH deben mantenerse relativamente constantes, dentro de unos límites vitales (7,35-7,45), y para asegurarlo existen diversos mecanismos muy eficaces.
Los principales mecanismos reguladores del pH son los amortiguadores, la respiración y la excreción renal de ácidos y bases.
- Amortiguadores:
Los amortiguadores son sustancias que impiden cambios notables en el pH de una solución cuando se le añade un ácido o una base.
Los principales sistemas tampón son:
- Ácido carbónico-bicarbonato
- Proteínas y aminoácidos
- Hemoglobina
- Fosfato
- Respiración:
La respiración es un elemento muy importante para mantener el pH dentro de los límites normales. La manera en la que la respiración influye en el pH es variando la frecuencia de respiración, hiperventilando o hipoventilando.
Para ello, existen neuronas en el centro respiratorio que son sensibles a modificaciones en la concentración de dióxido de carbono en la sangre arterial y a cambios en el pH de esta. Cuando la concentración no es correcta, se estimula el centro respiratorio:
- Si la concentración de dióxido de carbono en sangre es alta, es decir, si se trata de una acidosis, se produce hiperventilación a fin de eliminar el dióxido de carbono. Se debe tener en cuenta que, si esta es excesiva, se corre el riesgo de entrar en alcalosis.
- Si la concentración de dióxido de carbono es baja, es decir, si se trata de una alcalosis, se hipoventila para eliminar menor cantidad de este gas. En este caso, si la hipoventilación es excesiva, puede desembocar en acidosis.
Los desequilibrios de acidosis o alcalosis son condiciones en las que el pH del cuerpo varía, lo que indica un cambio en la concentración de iones de hidrógeno. Debido a las múltiples causas que lo ocasionan y a la consecuencia derivada, su origen puede ser respiratorio o metabólico.

Imagen 12. Fuente: Salusplay
4.2 VALORACIÓN DE LA FUNCIÓN RENAL DEL RN
La función renal del recién nacido es difícil de valorar de forma exacta, sobre todo en el prematuro. El sistema renal requiere un proceso de adaptación a la vida extrauterina, de modo que las interpretaciones de los resultados de las diferentes pruebas diagnósticas deben tener en cuenta la historia prenatal, el tipo de parto, la infusión de líquidos durante el mismo, la edad gestacional y la edad posnatal.
Los principales parámetros para valorar la función renal en el neonato son:
- Diuresis: Se mide en ml/kg/h. Se considera normal hasta 4 ml/kg/h, siendo poliuria, por encima de 4 y oliguria cuando es inferior a 1. Aunque la primera micción se suele realizar las primeras 24 h, un 7% lo realiza en las primeas 48h de vida.
- Balance de fluidos: Se deben contabilizar todas las entradas y salidas de líquido al paciente, por pequeñas que sean, incluyendo las pérdidas insensibles. En los pacientes graves es fundamental. Se expresan en % respecto al peso del neonato.
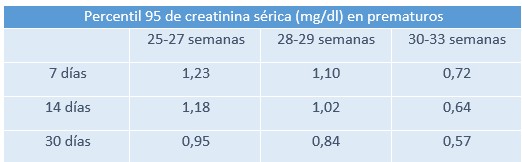
- Creatinina sérica: Es el parámetro clave para valorar la función renal ya que tiene muy buena correlación con la tasa de filtrado glomerular, mucho más difícil de calcular de forma precisa.
- El valor normal varía en función de la edad gestacional y los días de vida. Se calcula que los primeros 3 días de vida, el valor de Cr es equivalente al materno, en los neonatos a término disminuye durante las primeras 2 semanas hasta llegar a un valor de 0,2-0,4 mg/dl, mientras que en los prematuros el descenso es mucho más lento, estableciéndose en esas mismas cifras en torno al mes, dos meses de vida. En los grandes prematuros, por su parte, la Cr aumenta tras el nacimiento debido a la disminución del filtrado glomerular y la reabsorción tubular de creatinina y posteriormente disminuye hasta los 2 meses de vida.
- Osmolaridad urinaria: En los neonatos, la capacidad de concentrar orina es mucho más limitada que en niños más mayores y no suele ser > 700 mOsm/kg en los neonatos a término (y mucho menor en prematuros, factor que incrementa el riesgo de deshidratación)
- Fracción de excreción de sodio: Su valor normal no está definido claramente, pero si se sabe que es superior al del adulto o del niño mayor, por la menor capacidad de reabsorción de Na.
- Estudio de orina mediante tira reactiva: Puede resultar de utilidad para descartar hematuria, proteinuria o glucosuria, y a partir de aquí ampliar el estudio.
- Natremia, kaliemia y equilibrio ácido-base
- Ecografía renal con Doppler: Prueba de imagen de referencia, ya que valora muy bien las características de todas las estructuras del sistema urinario, incluida la vascularización.
4.3 TRASTORNOS DEL EQUILIBRIO HIDROELECTROLÍTICO
4.3.1 Trastornos del sodio
El sodio es el ion extracelular más abundante. Su acción es fundamental en la despolarización celular y el mantenimiento del volumen extracelular. Los desequilibrios de la concentración de este ion pueden causar hiponatremia o hipernatremia, afectando al equilibrio hidroelectrolítico.
4.3.1.1 Hiponatremia
Cuando la concentración de sodio sérico disminuye, el agua pasa a las células, lo que provoca edema. Cuando este edema se provoca en las células del cerebro, puede provocar síntomas como convulsiones, irritabilidad o letargia, así como apnea e insuficiencia respiratoria. Se considera hiponatremia una cifra de sodio sérico por debajo de 130 mEq/L, pudiendo sobrevenir el coma cuando el valor llega a 115 mEq/ L.
- Etiología:
- Volumen hídrico elevado
- Aumento de pérdida de sodio (p. ej. con el uso de diuréticos)
- Líquidos intravenosos hiperosmolares, que conllevan diuresis osmótica y pérdida de sales.
- Hiperglucemia: Diuresis osmótica.
- Pérdidas por el tubo digestivo: Diarrea vómitos, drenaje gástrico, defectos de la pared abdominal (gastrosquisis, Onfalocele)
- Disminución de la ingesta de sodio.
- Secreción inadecuada de la hormona antidiurética asociada a problemas del SNC (asfixia perinatal, hemorragia intravascular, hidrocefalia, meningitis…)
- Signos y síntomas:
- Edema generalizado.
- Variación brusca de peso: aumento si retención de líquido y pérdida si deshidratación.
- Signos de deshidratación: Baja producción de orina, piel menos turgente, mucosas secas, fontanelas hundidas.
- Apnea, letargia, irritabilidad.
- Convulsiones en las hiponatremias extremas (< 120 mEq/L) por el edema de las células cerebrales, causado por el intercambio del líquido extracelular hacia el intracelular.
- Tratamiento:
Se recomienda la restricción hídrica, disminuyendo 20 mL/kg/ día independientemente de su peso. Si la volemia es normal, mantener los aportes alrededor de 60 mL/kg/día.
Hay que calcular el déficit de sodio para corregirlo en perfusión intravenosa de suero salino 0,9% (154 mEq//L) o al 0,45% (77 mEq/L) y administrar entre 10 y 20 ml/kg despacio, mínimo en una hora. En casos de hiponatremia grave se puede usar cloruro sódico al 3% (0,5 mEq/ml) muy lento, en torno a las 24 horas, para evitar oscilaciones bruscas de líquido en el cerebro.
4.3.1.2 Hipernatremia
Sucede cuando hay una pérdida excesiva de agua, aumentando la concentración de sodio sérico con la consecuente elevación de la osmolaridad e hipertonicidad de la sangre. En este caso el líquido intracelular se desplaza al extracelular. Se considera hipernatremia la cifra de sodio en sangre > 150 mEq/L.
- Etiología:
- Aporte insuficiente de líquido.
- Pérdida insensible excesiva (piel y respiración)
- Administración de sodio excesiva.
- Diabetes insípida: déficit de hormona antidiurética que conlleva pérdida excesiva de agua.
- Signos y síntomas:
- Signos de deshidratación: Baja producción de orina, piel menos turgente, mucosas secas, fontanelas hundidas.
- Pérdida de peso.
- Irritabilidad, llanto estridente, letargia, convulsiones.
- Tratamiento:
- Corrección lenta de la hipernatremia grave para prevenir el edema de las células cerebrales.
- Disminución de las pérdidas insensibles de agua (aumento de la humedad del ambiente, uso de la incubadora con pared doble o carpa, con humidificación con calentamiento, humidificación de los gases cuando se use ventilación mecánica y oxigenoterapia, amiente térmico neutro, uso de crema tópica como Aquaflor ® para reducir la pérdida insensible de agua por la piel en los prematuros)
- Restricción a la administración de sodio.
- Control de diuresis, electrolitos séricos, urea, creatinina y peso corporal.
4.3.2 Trastornos del potasio
Es el ion intracelular más importante. Gracias al potasio y al sodio, mediante la bomba sodio-potasio, se regula la concentración intracelular. La necesidad diaria del recién nacido ya sea a término o prematuro, oscila entre 2 y 3 mEq/kg/día. La concentración sérica normal es de 3,5-5 mEq/L.
4.3.2.1 Hipopotasemia
Sucede cuando los niveles de potasio en sangre descienden por debajo de 3,5 mEq/L.
- Etiología:
Las pérdidas de potasio pueden deberse a:
- Diarrea, vómitos…
- Alteraciones renales.
- Medicamentos: diuréticos, insulina, corticoides, gentamicina…
- Alcalosis
- Hipercalcemia e hipomagnesemia.
- Signos y síntomas:
Las consecuencias de este trastorno se observan a nivel muscular en forma de distensión abdominal, disminución de la motilidad, debilidad muscular, efectos cardiacos como descenso del segmento ST, alargamiento del intervalo P-R y arritmias.
- Tratamiento:
- Aumentar la ingesta de potasio: 2-3 mEq/kg/día.
- La reposición de potasio se hace por medio de infusión lenta (0,5 y 1 mEq/L), evitando la infusión rápida por riesgo de arritmia mortal, monitorizando al paciente
- Tratamiento de las causas.
4.3.2.2 Hiperpotasemia
Sucede cuando el nivel de potasio sérico se encuentra en 6,5 mEq/L.
- Etiología:
- Infusión excesiva de potasio.
- Transfusión de sangre (frecuentemente la sangre antigua tiene hemólisis, lo que aumenta los niveles de potasio)
- Disminución de la diuresis: insuficiencia renal y suprarrenal (no se produce aldosterona), hiperplasia renal…
- Prematuridad del aparato urinario
- Intercambio de potasio del compartimento intracelular hacia el extracelular (hemorragia, equimosis, rotura rápida de los tejidos, acidosis…)
- Signos y síntomas:
- Cambios en el trazado del electrocardiograma, que manifiestan toxicidad cardiaca. Pudiendo haber fibrilación ventricular.
- Debilidad muscular, letargia, hipotonía y tetania.
- Tratamiento:
- Eliminación de toda fuente de potasio externa.
- Promoción de la pérdida de potasio (diuréticos, resina permutadoras como el Sorcal®, diálisis peritoneal)
- Administración de bicarbonato de sodio, glucosa hipertónica e insulina.
- Exanguinotransfusión.
4.3.3 Trastornos del calcio
El calcio es un ion importante para el mantenimiento de la pared celular, participa en la cascada de coagulación, en la contracción muscular y es necesario para la transmisión de impulsos nerviosos.
Esta molécula está regulada por la hormona paratiroidea, que estimula el desplazamiento del calcio desde el hueso a la sangre.
Las primeras 48-72 horas de vida, la producción de esta hormona es baja, lo normal es que, en ese tiempo, los niveles de calcio desciendan para normalizarse a partir del tercer día.
Se consideran normales niveles de calcio total entre 9,1 y 10,6 mg/dl y de calcio ionizado entre 3,5 y 4 mg/dl.
Por otro lado, cabe mencionar el papel de la vitamina D en relación con el calcio, pues su acción aumenta la absorción de calcio intestinal.
4.3.3.1 Hipocalcemia
Sucede cuando los niveles de calcio total son de 7 mg/dl y de calcio ionizado de 4,4 mg/dl.
- Etiología
- Almacenamiento inadecuado de calcio: en niños prematuros es habitual, pues antes del tercer trimestre el feto almacena calcio; insuficiencia placentaria (en niños postérmino la placenta no transfiere calcio al feto), retraso del crecimiento intrauterino.
- Regulación hormonal inmadura: En los neonatos hijos de madre diabética la producción de hormona paratiroidea se retrasa aún más.
- Asfixia y estrés en el parto reducen los niveles de calcio.
- Interferencia con el uso del calcio: exanguinotransfusión (el calcio se liga al anticoagulante citrati, que utiliza en la sangre por ser infundida)
- Déficit de vitamina D, aumento de fósforo, hipomagnesemia.
- Diuréticos como la furosemida aumentan la eliminación de calcio por la orina.
- Acidosis tubular renal.
- Ayuno prolongado.
- Signos y síntomas:
- Inicio temprano: Apnea, irritabilidad, temblores, estremecimientos, tetania, hipertonía, convulsiones, alteraciones en el electro (intervalo QT prolongado) arritmias.
- Inicio tardío: desmineralización ósea, fracturas, fosfatasa alcalina elevada, raquitismo.
- Tratamiento:
Administración de gluconato cálcico al 10%, entre 200 y 800 mg/kg/día de forma intravenosa. Evitar concentraciones mayores a 3 mg/ml en 24h para evitar lesiones en los tejidos en caso de extravasación, debido a su carácter irritante.
En caso de que no sea suficiente, se puede administrar calcio elemental, entre 18 y 75 mg/kg en un periodo de infusión lenta de entre 4 y 6 horas.
Es importante mantener la monitorización cardiaca constante durante la infusión, para detectar arritmias, en caso de producirse bradicardia, se debe suspender la infusión.
Cuando se realiza una exanguinotransfusión con sangre citrada, se administra gluconato de calcio al 10% en la dosis de 100 mg por cada 100 ml de sangre transfundida.
Será necesario administrar un suplemento de vitamina D y normalizar los niveles de fósforo y magnesio. En el caso de que el paciente tenga alcalosis (pH> 7,5), se debe administrar suplemento de calcio.
4.3.3.2 Hipercalcemia
Sucede cuando los niveles de calcio total son > 11 mg/dl y los de calcio ionizado, > 5,4 mg/dl.
- Etiología:
- Insuficiencia de la glándula suprarrenal.
- Hipervitaminosis A y D.
- Administración excesiva de calcio y vitamina D.
- Trastornos de la tiroides y la paratiroides.
- Depleción de fósforo.
- Tratamiento con diuréticos.
- Signos y síntomas:
- Poliuria
- Bradicardia
- Estreñimiento
- Tratamiento:
- Promoción de la excreción urinaria de calcio (por medio de hidratación)
- Administración de glucocorticoides (disminuye la absorción intestinal y ósea del calcio)
- Suspensión de la administración de vitamina D y calcio.
- Limitación de la exposición solar.
4.3.4 Trastornos de la glucosa
Durante la vida intrauterina, el feto obtiene glucosa por difusión a través de la placenta. Esta glucosa que consiguen las células está disponible para su uso inmediato o bien para su almacenamiento en forma de glucógeno en el hígado, hecho que comienza a partir de la semana 19 de gestación, siendo cada vez mayor, especialmente en el tercer trimestre.
Una vez que el bebé nace, la glucosa que antes proporcionaba la placenta debe ser producida por sí mismo.
La glucosa es una molécula muy importante ya que es la fuente de energía de todos los tejidos. Su función es a su vez regulada por la insulina, hormona secretada por el páncreas, que permite su entrada al interior de las células.
Los recién nacidos, son más vulnerables, debido a su inmadurez, a los desequilibrios de glucosa en los primeros días de vida. En general, durante las primeras 2-3 horas de vida, el bebé consume todo el glucógeno que había almacenado en su vida fetal. Hay algunos recién nacidos que, por sus características, tienen mayor riesgo de desequilibrio por lo que se realizarán controles de glucemia sanguínea al nacimiento y antes de cada toma durante el primer día de vida o hasta que la cifra de glucemia se estabilice en un rango normal.
- Neonatos grandes para la edad gestacional (más de 4 kg) o pequeños para la edad gestacional (menos de 2,3 kg)
- Hijos de madre diabética.
- Neonatos menores de 37 semanas.
- Neonatos con temperatura inferior a 36,2 ºC después del nacimiento.
Aunque todavía no se ha llegado a un consenso total sobre las cifras que consideran normales, en la mayoría de las UCIN se toman como valores de referencia de la normalidad cifras ente 40 y 150 mg/dl.
De cara a nuestro trabajo, cabe destacar la importancia de una buena técnica de punción del talón, destacando la zona de punción en los laterales del mismo, y la temperatura de la zona, que si está muy fría puede dar resultados de falsos negativos.
4.3.4.1 Hipoglucemia
Sucede cuando los niveles son menores de 45 mg/dl, independientemente de si el paciente es a término o prematuro. Se recomienda un nivel de glucosa en sangre > 45 mg/dl para todos los recién nacidos sea cual sea su peso y edad gestacional.
Hay una serie de factores que contribuyen a que el recién nacido tenga hipoglucemia:

- Signos y síntomas:
Algunos pacientes se manifiestan asintomáticos, en otros casos pueden aparecen signos como: temblores, irritabilidad, llanto estridente, convulsiones, apnea, cianosis, letargia e hipotonía, hipotermia, taquipnea, diaforesis, dificultad o rechazo del alimento.
- Diagnóstico:
- Glucemia sanguínea capilar o plasmática.
- Si la hipoglucemia persiste más de 2 o 3 días, se controlarán los niveles de insulinas, cortisol, hormonas tiroideas y del crecimiento.
- Tratamiento:
Destinado a corregir el problema y prevenir secuelas neurológicas como lesiones cerebrales y retraso mental.
- Infusión rápida de glucosa 10%: 4 ml/kg, en 120 minutos.
- Perfusión continua de solución glucosada para mantener estable la glucemia entre 60 y 120 mg/dl; se recomienda empezar con una velocidad de 5-7 mg/kg/min.
- Hidrocortisona: Promueve la glucogénesis.
- Glucagón: promueve la estimulación de la glucogenólisis, se usa como tratamiento de emergencia.
- Tratar causas subyacentes.
4.3.4.2 Hiperglucemia
Sucede cuando los niveles de glucosa superan los 180 mg/dl. Con estos niveles aumenta la osmolaridad, que hace que se contraiga el espacio intracelular desencadenando diuresis osmótica o deshidratación, así como que se produzca hemorragia craneal intravascular.
- Etiología:
- Administración excesiva de glucosa.
- Intolerancia a la glucosa, sobre todo en neonatos excesivamente prematuros.
- Ciertos fármacos como corticoides.
- Septicemia.
- Respuesta al estrés.
- Hiperinsulinemia.
- Signos y síntomas:
Suele ser asintomático, pero también se puede observar diuresis osmótica, eliminación de glucosa en orina y deshidratación (secundaria a esa diuresis osmótica)
- Diagnóstico:
- Pruebas de glucosa en orina por cinta reactiva.
- Glucosa sanguínea.
- Hemograma para evaluar si hay un cuadro infeccioso.
- Niveles de insulina.
- Tratamiento:
Cuando la glucemia es > 180 mg/dl, se administra una dosis única de insulina regular intravenosa, entre 0,05 y 0,1 unidad/kg, a pasar lento entre 15 y 20 minutos. Realizar un control de glucemia a la hora de la administración.
Si la hiperglucemia persiste, se iniciará una perfusión continua de insulina entre 0,02 y 0,1 unidad/kg/h, haciendo controles horarios hasta que se estabilice, y después cada 4 horas.
Si, aun así, la hiperglucemia persiste, aumentaremos la dosis a 0,01 unidad/kg/h.
Cuando la glucemia descienda a 80mg/dl, está indicado detener la infusión de insulina y continuar haciendo controles, cada 30 minutos-1 hora hasta su estabilización.
Puede ocurrir que se produzca una hipoglucemia con la infusión de insulina. Siempre debe administrarse mediante bomba de infusión. Antes de conectar al paciente, es preciso usar un chorro de la solución, unos 10 ml, para lavar la jeringa y la conexión, lo que reduce la adhesión de la insulina al plástico que podría disminuir así la concentración del medicamento y conllevar más tiempo para lograr el efecto deseado.
La administración de insulina con solución glucosada también se utiliza para la disminución de los niveles de potasio en casos de hiperpotasemia; esta solución hace que el potasio extracelular entre en las células para disminuir así el potasio circulante.
4.4 PATOLOGÍA NEFROUROLÓGICA EN EL PACIENTE NEONATAL
4.4.1 Infección del tracto urinario. ITU
La ITU es la infección bacteriana más frecuente en el neonato con fiebre. Su clínica en este grupo de pacientes es inespecífica, incluyendo fiebre, rechazo del alimento vómitos, estancamiento ponderal e hiperbilirrubinemia (de predominio conjugado). En ocasiones por la dificultad de recogida de la muestra, los resultados pueden estar sobreestimados.
En este grupo etario, la prevalencia es mayor en varones, así como en prematuros frente a neonatos nacidos a término y en aquellos con malformaciones congénitas del riñón y el tracto urinario (CAKUT).
Los gérmenes más frecuentes son:
- En neonatos a término: E. Coli (80%)
- En hospitalizados, sobre todo pretérmino: Klebsiella
El diagnóstico se basa en el resultado del urocultivo:
- Si la muestra se obtiene por sondaje vesical, se considera positivo > 50000 Unidades Formadoras de Colonias (UFC) o entre 10000-50000 UFC si lleva asociadas alteraciones en el uroanálisis (> 5 leucocitos/ campo)
- Si la muestra se obtiene por punción suprapúbica se considera positivo cualquier recuento.
- En aquellos neonatos con sospecha y/o ITU confirmada se debe realizar también un hemograma, con PCR y procalcitonina, así como hemocultivo.
- Si el paciente tiene aspecto séptico o hallazgos neurológicos en la exploración también está indicada la punción lumbar.
- Se debe realizar ecografía renal en los neonatos con ITU debido a la elevada prevalencia de CAKÚT (malformaciones congénitas) dejando la gammagrafía (DMSA) tardía para ITUS graves.
- En caso de alteraciones ecográficas, gammagráficas, ITU recurrentes o causadas por E. coli, se recomienda también realizar cistografía para descartar reflujo vesicouretral.
El tratamiento se basa en antibioterapia intravenosa, en caso de sospecha, de forma general, se pauta ampicilina y gentamicina, y en casos de insuficiencia renal o sospecha de afección meníngea, el tratamiento de elección serán las cefalosporinas de 3ª generación.
La duración del tratamiento oscila entre 10 y 14 días.
4.4.2 Reflujo vesicouretral.RVU.
Es el reflujo retrógrado no fisiológico de orina desde la vejiga al uréter, en probable relación con una disfunción de la unión ureterovesical. Puede estar asociada en varones a otras anomalías como displasia renal o válvulas de uretra posterior.
Hay 5 grados:
- I-II: leve.
- III: moderado.
- IV-V: grave.

Imagen 11. Fuente: Protocolos SENEO 2023
- El diagnóstico se realiza mediante cistouretrografía miccional seriada (CUMS), siendo la cistografía isotópica y la ecocistografía miccional con contraste alternativas en el seguimiento y diagnóstico inicial en el sexo femenino.
- El tratamiento depende del grado de afección y su evolución. Se emplea profilaxis antibiótica a partir de los casos moderados/graves (IV-V en varones y III-V en mujeres) especialmente si se asocian a ITUS de repetición, antes de su corrección quirúrgica.
El antibiótico de elección es la amoxicilina con o sin clavulánico (10-15 mg/kg dosis única) siendo una alternativa adecuada el uso de cefalosporinas de primera generación.
4.4.3 Hidronefrosis
Consiste en la dilatación de la pelvis renal con o sin dilatación de los cálices renales, la mayoría son transitorias y fisiológicas, pero también pueden ser causadas por malformaciones congénitas del aparato urinario (CAKUT)
El manejo de esta patología debe incluir:
- Anamnesis: Detallando antecedentes obstétricos maternos y familiares.
- Exploración física: que incluya valoración pulmonar, sobre todo si asocia oligoamnios severo, se deben descartar masas abdominales, vejiga urinaria palpable o malformaciones asociadas (p. ej. arteria umbilical única o criptorquidia)
- Pruebas de imagen: La prueba de elección es la ecografía, indicada en todas las dilataciones con DAP > o igual a 7 mm a partir de las 32 semanas de gestación.
- La cistografía (CUMS) y/o ecocistografía están indicadas en dilataciones uni o bilaterales severas y sospecha de obstrucción del tracto urinario inferior.
- En casos de dilatación grave, se recurre al renograma para descartar obstrucción y valorar la función renal. Esta prueba se realiza preferiblemente a partir de los 2-3 meses, estando desaconsejada antes del mes de vida.
- Profilaxis antibiótica: Indicada en dilataciones graves (DAP> o igual a 15), asociación con infecciones urinarias de repetición o RVU de alto grado. En las dilataciones moderadas se deja a criterio médico debido a la controversia que aún hay. El antibiótico de elección es la amoxicilina con o sin clavulánico (10-15 mg/kg dosis única) siendo una alternativa adecuada el uso de cefalosporinas de primera generación.
4.4.4 Válvulas de uretra posterior. VUP
Pliegues membranosos en la uretra posterior que obstruyen la salida del flujo urinario desde la vejiga.
Se da únicamente en varones, y es la causa más común de obstrucción del flujo urinario. La mayoría se diagnostican de forma prenatal, donde se ve la imagen típica de vejiga dilatada, hipertrofia de la pared vesical, uretra posterior dilatada y una hidronefrosis bilateral. Los casos graves se asocian a oligoamnios e hipoplasia pulmonar.
El diagnóstico antes de las 24 semanas de gestación está asociado a una alta mortalidad perinatal o enfermedad renal crónica.
El pronóstico se relaciona con el grado de displasia renal y el desarrollo de hipoplasia pulmonar. Aunque en centros especializados ya se realizan intervenciones quirúrgicas en el periodo fetal, con el objetivo de disminuir la afección renal y la hipoplasia pulmonar, los resultados no son todavía concluyentes.
En el periodo neonatal el tratamiento de elección es mediante endoscopia para la ablación de las VUP. Puede estar indicada la derivación urinaria en caso de fracaso del tratamiento endoscópico o en situaciones específicas.
4.4.5 Insuficiencia renal aguda
Se define como la lesión renal aguda que conlleva una reducción importante del filtrado glomerular, que repercute en la función renal. Afecta hasta el 20-40% de los recién nacidos ingresados en unidades de intensivos neonatales.
Los principales factores de riesgo son la asfixia perinatal, las cardiopatías congénitas y la prematuridad.
A nivel cuantitativo, podemos hablar de IRA cuando la Cr, es mayor a 1,5 mg/dl o experimenta un incremento de 0,2-0,3 mg/dl al día.

En cuanto a su pronóstico, dependerá de la gravedad del caso y de cuál sea su causa. Se recomienda que todos los pacientes con IRA tengan un seguimiento del pediatra especializado en nefrología.
- Etiología:
Puede tener un origen prerrenal, renal o postrenal.

- Tratamiento:
- Balance hídrico: el paciente puede presentar edema generalizado. Si hay oliguria intensa o anuria, las entradas no deben superar las pérdidas insensibles + la diuresis, pero en caso de que la causa fuera uropatía obstructiva, tras la resolución de la obstrucción puede haber poliuria intensa, lo que se debe compensar aumentando las entradas para evitar el daño prerrenal agudo.
- Diuréticos
- Ajuste de dosis: hay muchos fármacos de eliminación renal cuya dosis debe ajustarse o suspenderse en caso de IRA.
- Manejo de alteraciones electrolíticas
- Manejo de acidosis metabólica: el uso de bicarbonato no está recomendado actualmente, en caso de acidosis metabólica grave y persistente, se debe plantear una técnica de reemplazo renal.
- Manejo de la hipertensión arterial.
4.4.6 Síndrome nefrótico congénito
Conjunto de patologías de origen principalmente genético (el más frecuente y grave es el finlandés) que se caracterizan por proteinuria masiva, hipoalbuminemia grave y edema que se presenta durante los 3 primeros meses de vida. Aunque en la mayoría de los pacientes la causa es genética, un pequeño porcentaje responde a infecciones congénitas, por lo que resulta imprescindible descartarlas ante sospecha de síndrome nefrótico.
- Fisiopatología: Se produce por una alteración en la membrana de los podocitos, ello provoca una proteinuria grave al aumentar la permeabilidad a moléculas mayores.
- Manejo: El SNefC finlandés es resistente a corticoides e inmunosupresores al no tener un origen ni inflamatorio ni inmunológico. El tratamiento definitivo es el trasplante renal, pero hasta que eso llegue, se debe corregir, aunque sea de forma parcial.


Imagen 12. Fuente: Protocolos SENEO 2023
- Se recomienda:
- Para valorar la función renal neonatal, tener en cuenta el grado de desarrollo de los riñones.
- En caso de insuficiencia renal aguda neonatal, realizar un manejo escrupuloso del balance de líquidos, ya que el 85% de los casos son de origen prerrenal y suelen acompañarse de oliguria o anuria.
- Considera el diagnóstico de síndrome nefrótico congénito en caso de hipoalbuminemia grave y edemas generalizados.
4.4.7 Hipertensión arterial neonatal. HTA
Se define como la presión arterial sistólica (PAS) o diastólica (PAD) superior al p95 (+2DE), en 3 tomas realizadas en momentos distintos, según los valores de referencia para la edad (gestacional y postnatal).
- En el pretérmino la presión arterial va en correlación con su edad gestacional y días de vida. A lo largo de las dos primeras semanas de vida, se va produciendo un aumento progresivo de las cifras.
En este grupo, de forma general, consideraremos HTA en los siguientes casos:
- Recién nacido pretérmino < 28 semanas: valores > 70/50 mmHg.
- Pretérmino > 28 semanas: valores > 80/50 mm/Hg.
- A partir de los 14 días de vida ya se consideran las cifras de los nacidos a término: valores > 90/60 mm/Hg.
- En el recién nacido a término, en las primeras 24 horas de vida, las cifras normales son en torno a 70/40 (55) mm/Hg. Durante las dos primeras semanas, se produce un aumento fisiológico de 1-2 mm/Hg al día, hasta llegar a 90/55, cifras que se mantendrán a lo largo del primer año de vida.
A efectos prácticos, una presión arterial de 90/60 en un nacido a término, requiere evaluación.

Imagen 13. Fuente: SENEO, protocolos Junio 2023

Imagen 14. Fuente: SENEO, protocolos Junio 2023
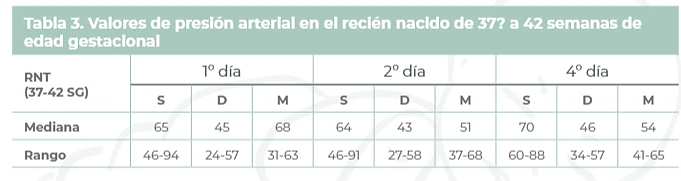
Imagen 15. Fuente: SENEO, protocolos Junio 2023

Imagen 16. Fuente: SENEO, protocolos Junio 2023

Imagen 17. Fuente: SENEO, protocolos Junio 2023
4.4.7.1 Etiología
Las causas más frecuentes de HTA en el neonato son las anomalías del parénquima renal y la enfermedad renovascular.
Cabe destacar la HTA secundaria a la canalización de la arteria umbilical. El catéter lesiona el endotelio del vaso, dando lugar a trombos que pueden ser difícilmente visibles en la ecografía, disminuye el flujo sanguíneo, originando una elevación de la producción de renina que exacerba la HTA.
Por otro lado, la displasia broncopulmonar (DBP) es la causa no renal más frecuente en el recién nacido prematuro, su relación parece establecerse por el aumento de actividad simpática y de la angiotensina II, y se correlaciona con la gravedad de la enfermedad, así mismo, los neonatos que reciben corticoides postnatales presentan un riesgo mayor de padecer HTA que aquellos que no reciben dicho fármaco.
Otras causas de HTA que no debemos pasar por alto son: anomalías endocrinas, causas neurológicas, uso de ciertos fármacos y la presencia de dolor, que también puede desencadenar un aumento de la presión arterial en el recién nacido.
4.4.7.2 Clínica
La sintomatología es muy variable, con síntomas inespecíficos y sin una buena correlación entre la gravedad de la enfermedad y la clínica asociada. En general, podemos agrupar los síntomas de la siguiente manera.

4.4.7.3 Diagnóstico
Aunque el método más exacto es la monitorización invasiva (intraarterial), el más usado y extendido es la medición no invasiva. Para que sea fiable, es imprescindible ceñirse al protocolo y confirmar las cifras en determinaciones seriadas durante 6-12 horas si la situación clínica lo permite:
- Posición en DP.
- Método oscilométrico.
- Tamaño del maguito adecuado (Hay que medir la circunferencia de la extremidad del paciente y la anchura del maguito por la zona que se infla, la relación entre ambas medidas debe ser 0,4-0,5 cm. Los manguitos neonatales van de 2 a 4 cm)
- Miembro superior derecho.
- Dormido o en alerta tranquila.
- Tras colocar el maguito, dejar al paciente tranquilo y tomar la tensión 15 minutos después.
- Preferiblemente a las 1,5 horas de la toma o manipulación.
- Realizar al menos 3 determinaciones cada 2 minutos.
- Ante sospecha de HTA:
- Revisar posibles errores de medición, teniendo en cuenta la situación de dolor o disconfort del neonato. Confirmar la sospecha con determinaciones seriadas cada 6-12 horas.
- Debe identificarse la causa mediante una adecuada anamnesis y exploración física. Se deben palpar los pulsos en los 4 miembros, así como la medición de la PA también debe hacerse en las 4 extremidades, buscaremos rasgos dismórficos, masas abdominales o genitales ambiguos.
- Estudios de primer nivel:
- Hemograma, urea, creatinina, Na, K, Cl, Ca, gasometría.
- Sedimento, iones en orina.
- Eco Doppler renal.
- En función de la causa que se sospeche pueden ser necesarias otras pruebas como:
- Ecocardiograma.
- Fondo de ojo.
- Estudio hormonal.
- Otras pruebas de imagen.
4.4.7.4 Tratamiento
Se aconseja iniciar el tratamiento ante una HTA sintomática, si existe repercusión ecocardiográfica o si las cifras de PA se mantienen por encima del p99.
- En caso de HTA grave, sintomática se recomienda iniciar tratamiento inmediato con nicardipino en perfusión continua (0,5 µg/kg/ min ajustándose progresivamente según la respuesta). Debemos monitorizar de manera continua la PA durante la administración de fármacos hipotensores ya sea de forma invasiva o no invasiva cada 10-15 minutos.
- Se recomienda evitar el descenso brusco de la PA, pues puede aumentar la incidencia de isquemia y/o hemorragia cerebral, sobre todo el prematuros. Por esta razón, sería interesante la monitorización con NIRS durante la infusión intravenosa. Cuando la PA esté controlada, se pasará el tratamiento a vía oral, inicialmente a dosis mínima, aumentando progresivamente después según sean necesario.
- En el resto de los casos el tratamiento será inicialmente oral. Cabe destacar aquí que no se recomiendan los IECAS hasta la edad posmenstrual de 44 semanas, por el riesgo de hipoperfusión renal y posible alteración de la maduración renal. Las opciones mejor valoradas son el amlodipino o la hidralazina en solución oral. Del mismo modo debemos tener cuidado con el uso de betabloqueantes por el riesgo de broncoespasmo.
4.5 TÉCNICAS EN EL PACIENTE NEONATAL CON PROBLEMAS RENALES
4.5.1 Depuración renal en neonatología
El número de neonatos que requiere terapia de reemplazo renal (TTR) es muy bajo con respecto a otras edades, no obstante, cada vez más, en las unidades de intensivos neonatales se está recurriendo a esta terapia, incluso en el caso de niños prematuros.
La terapia de reemplazo renal consiste en el intercambio de moléculas entre dos soluciones, separadas entre sí por una membrana semipermeable. Las posibles indicaciones en el neonato van dirigidas hacia el tratamiento de insuficiencia renal aguda, disfunción multiorgánica y la corrección de errores innatos del metabolismo, que cursan con hiperamonemia.
Dentro de las TRR tenemos:
- Hemodiálisis (HD): En neonatología es menos utilizado, dada la necesidad de un cierto grado de estabilidad del paciente, la dificultad del acceso vascular, así como de un elevado volumen de sangre que el recién nacido no posee. Además, el recién nacido no suele tolerar los cambios rápidos de volumen plasmático, por lo que será preferentemente tratado con diálisis peritoneal. No obstante, en caso de utilizarla, la terapia más usada es la hemofiltración.
- Hemofiltración venovenosa continua: Permite la extracción de ultrafiltrado desde la circulación sanguínea y depuración de solutos mediante convección, a través de un filtro, con solución de reposición prefiltro o posfiltro. La principal indicación de esta técnica es la hiperamonemia grave que no responde a tratamiento médico.
Se implanta de forma continua 24 horas al día, 7 días a la semana.
La técnica consiste en extraer sangre del territorio venoso mediante un catéter, bombearla a través de un dializador y devolverla a través de un catéter venoso del paciente.
El material necesario es el siguiente: dializador biocompatible, monitor multiparamétrico, equipo estéril y líquidos para la técnica elegida.
Cada 72 horas es recomendable cambiar el filtro.
- Diálisis peritoneal (DP): Es más fácil de utilizar en el neonato, pero los resultados son menos efectivos, si los comparamos con el resto de las terapias de remplazo renal.
Esta modalidad de depuración extrarenal tiene más tasa de éxito en el neonato crítico. La técnica resulta mucho más sencilla que otros métodos, disminuye el número de conexiones, tiene mejor tolerancia incluso en los prematuros, y tiene un coste menor.
La técnica de DP utiliza el peritoneo como una membrana dialítica que permite que el agua y los solutos de bajo peso molecular se intercambien con la sangre.
Utiliza un catéter ubicado en la pared abdominal, este catéter se puede colocar por punción directa o por técnica Seldinger. Actualmente esta última es la técnica que más se utiliza por las ventajas en cuando a su inserción y el menor riesgo de complicaciones que asocian
Además, en recién nacido, el área peritoneal efectiva es bastante mayor que en el adulto.
- Indicaciones: Necrosis tubular aguda, errores del metabolismo, síndrome nefrótico congénito, riñones poliquísticos bilaterales y agenesia renal.
- Complicaciones: La principal complicación es la infección de la cavidad peritoneal, otras que se pueden producir son la hiperglucemia, la fuga del catéter, la obstrucción del catéter y la perforación abdominal.
- Contraindicaciones: Las únicas contraindicaciones absolutas son pacientes con defectos en la pared abdominal (gastrosquisis, Onfalocele o hernia diafragmática) y las fístulas pleuroperitoneales.
- Material necesario: Catéter apropiado al peso del paciente, líquido de diálisis peritoneal, circuito y sistema de calentamiento.
- Funcionamiento: Infusión del líquido de diálisis a través del catéter del abdomen. El peritoneo actúa como membrana dializadora, filtrando y eliminando los desechos de la sangre. Para ello utiliza los siguientes mecanismos: disfunción por gradiente de concentración y convención por gradiente osmótico.
- Monitorizaremos: Peso diario, balance hídrico, glucemia capilar, electrolitos, cultivo del líquido y monitorización cardiorrespiratoria.
4.6 DIAGNÓSTICOS DE ENFERMERÍA
A continuación, se resumen los diagnósticos de enfermería más importantes en pacientes con estas patologías, ordenados según los dominios de la última clasificación de diagnósticos NANDA 2021-2023.
Dominio 2: Nutrición
- 00179 – Riesgo de nivel de glucosa en sangre inestable
- 00195 – Riesgo de desequilibrio electrolítico
- 00025 – Riesgo de volumen de líquido desequilibrado
- 00027 – Volumen de líquido deficiente
- 00028 – Riesgo de volumen de líquido deficiente
- 00026 – Exceso de volumen de líquido
Dominio 3: Eliminación e intercambio
- 00023 – Retención urinaria
- 00322 – Riesgo de retención urinaria
Dominio 4: Actividad reposo
- 00267 – Riesgo de presión arterial inestable
Dominio 11: Medida de seguridad
- 00250 – Riesgo de lesión del tracto urinario
BIBLIOGRAFÍA
- Moreno-Alfonso JC, Peñarrieta-Daher A, Peña M, Zalles-Vidal C. Atresia de esófago y malformaciones de la vía aérea: más allá de la fístula traqueoesofágica. An Pediatr (Barc). 2023;99(2):143-144.
- Maldonado J, Royo Y, Pueyo C, Skrabski R, Di Crosta I. Urgencias quirúrgicas en la vía digestiva. Hospital Universitario Joan XXIII, Tarragona. An Pediatr (Barc). 2023;99(2):143-144.
- Barrena Delfa S, Luis Huertas AL. Malformaciones congénitas digestivas. Pediatr Integral. 2019; XXIII (6):301-309
- Alonso Cadenas JA, de la Torre Espí M. Diagnóstico y tratamiento del dolor abdominal agudo (abdomen agudo) en Urgencias. Protoc diagn ter pediatr. 2020; 1:197-213.
- Moreno Sanz-Gadea B, Udaondo Gascón C, Sellers Carrera M, Martín Sánchez J, de Ceano-Vivas La Calle M. Lactante con vómitos, ¿cuándo sospechar un vólvulo intestinal? The vomiting infant: When should intestinal volvulus be suspected? An Pediatr (Barc). 2018;88(2):109-111.
- Demestre Guasch X, Raspall Torrent F. Enterocolitis necrosante. Servicio de Pediatría y Neonatología SCIAS. Hospital de Barcelona. Grup Assistència. Barcelona. An Pediatr (Barc). 2023;99(2):143-144. doi: 10.1016/j.anpedi.2023.02.003
- Sociedad Española de Neonatología. Protocolos de la Sociedad Española de Neonatología 2023. Madrid: SENEO; 2023
- Zozaya C, Avila-Alvarez A, Somoza Argibay I, García-Muñoz Rodrigo F, Oikonomopoulou N, Encinas JL, Saenz de Pipaón M, Couce ML. Prevención, diagnóstico y tratamiento de la enterocolitis necrosante en recién nacidos menores de 32 semanas al nacimiento en España. An Pediatr (Barc). 2020;93(3):161-169.
