La selección de donantes y receptores es un proceso complejo y crucial para el éxito de un trasplante. Se deben considerar múltiples factores, como la compatibilidad sanguínea y de tejidos, la edad y el estado de salud del donante y receptor, así como la urgencia del trasplante. Los equipos médicos realizan evaluaciones exhaustivas para garantizar la mejor coincidencia posible y minimizar el riesgo de rechazo.
A lo largo del siguiente bloque comentaremos los aspectos más importantes de la regulación fisiológica que rige nuestro sistema inmunitario, así como los criterios adecuados no solo para la selección de donantes y receptores, sino para asegurar una adecuada compatibilidad entre ellos.
2.1 Sistemas de compatibilidad inmunológica
La compatibilidad inmunológica entre el donante y el receptor es uno de los pilares fundamentales del trasplante sin el cual este no es posible. La afinidad entre partes es imprescindible para que la respuesta inmunitaria no genere daño en el injerto. Durante este capítulo comentaremos algunos de los aspectos fundamentales.
En primer lugar, se hace necesario comentar que la reacción inmunitaria varía con el tipo de trasplante realizado. Se utilizan los siguientes términos para referirse a las distintas modalidades:
- Autotrasplante: Es el trasplante de un tejido u órgano dentro del mismo individuo. No genera respuesta inmunológica porque el injerto proviene del propio paciente. Ejemplo: injerto de piel en quemaduras o el trasplante de médula ósea autóloga.
- Singénico: Se da entre individuos genéticamente idénticos, como gemelos monocigóticos. Al no haber diferencias antigénicas, no se produce rechazo inmunológico. Ejemplo: el primer trasplante renal exitoso en 1954 entre gemelos idénticos.
- Alogénico: Es el trasplante de un órgano o tejido entre individuos de la misma especie pero con diferencias genéticas. Este tipo de injerto requiere inmunosupresión para prevenir el rechazo. Ejemplo: el trasplante renal de un donante fallecido a un receptor humano.
- Xenogénico: Se refiere al trasplante entre especies diferentes. Presenta un alto riesgo de rechazo inmunológico debido a las grandes diferencias antigénicas. Ejemplo: el uso experimental de válvulas cardíacas de cerdo en humanos.
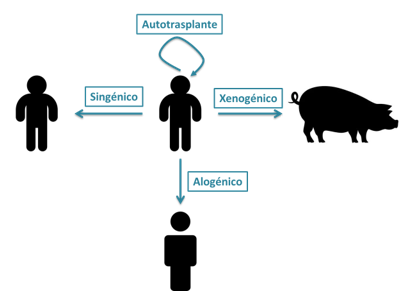
Ilustración 15: Tipo de trasplante según la relación entre donante y receptor
Los autoinjertos e injertos singénicos suelen ser muy bien aceptados gracias a la identidad genética entre el injerto y el hospedador. Como el aloinjerto es diferente desde el punto de vista genético al hospedador, por lo general el sistema inmunitario lo reconoce como extraño y, por este motivo, lo rechaza. Y, desde luego, los xenoinjertos son los que plantean la disparidad genética más grande y, en consecuencia, suscitan una reacción intensa de rechazo.
2.1.1 Sistema AB0
Aunque parece obvio, una de las causas inmediatas de rechazo sería la incompatibilidad en el grupo sanguíneo de los pacientes. Como es sabido ampliamente, estos marcadores de membrana deben estudiarse cuidadosamente en la trasfusión de derivados sanguíneos, pero también en lo correspondiente al trasplante renal.
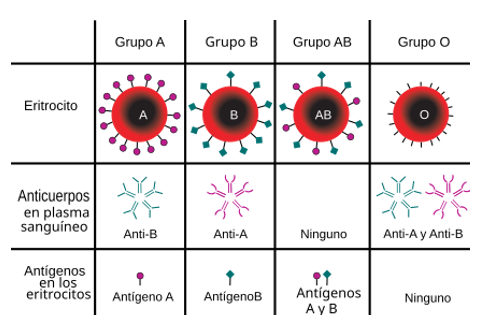
Ilustración 16: Eritrocitos según el sistema AB0. No se ha tenido en cuenta el estudio Rh (+ o -). Fuente: Wikipedia; disponible en: https://es.wikipedia.org/wiki/Grupo_sangu%C3%ADneo
La no existencia del antígeno A, B, Rh o la combinación de ambos supone la generación de anticuerpos contra tal marcador en el individuo. Si este individuo acaba siendo receptor de un órgano, tejido, o componente de otra persona que sí poseyera dichos marcadores, se generaría de inmediato una respuesta inmunitaria, ya que los anticuerpos (principalmente contra A y contra B; contra Rh requiere una exposición previa) estarían generados.
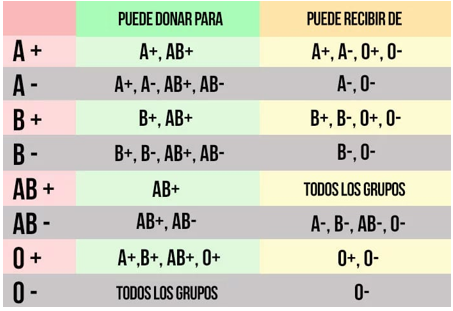
Ilustración 17: Quién puede donar y recibir de quién. Fuente: MDSaude; disponible en: https://www.mdsaude.com/es/hematologia-es/grupos-sanguineos-abo/
Como decimos, la incompatibilidad de grupo sanguíneo puede provocar un rechazo inmediato del injerto debido a la presencia de anticuerpos preformados contra los antígenos del grupo ABO del donante.
2.1.2 Sistema HLA
El complejo mayor de histocompatibilidad (MHC) es un grupo de genes localizados en una secuencia continua de ADN. En los seres humanos, estos genes se encuentran en el cromosoma 6, mientras que en los ratones están en el cromosoma 17.
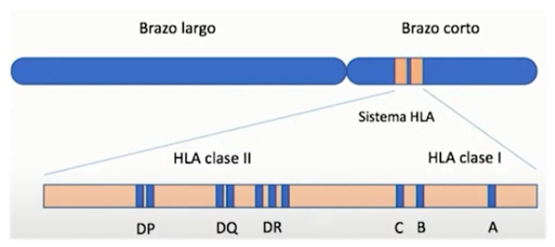
Ilustración 18: Representación del cromosoma 6 y localización de los genes que codifican para HLA I y II
En los humanos, el MHC se conoce como complejo HLA, mientras que en los ratones se denomina complejo H-2. Aunque la disposición exacta de los genes varía entre ambas especies, en ambos casos están organizados en regiones que codifican tres clases de moléculas:
- MHC Clase I: Se encuentra en la mayoría de las células nucleadas del organismo. Su principal función es presentar péptidos endógenos (derivados de proteínas intracelulares) a los linfocitos T citotóxicos (CD8⁺). Es fundamental para la vigilancia inmunitaria y la eliminación de células infectadas por virus o transformadas en cancerígenas. En humanos, está codificado por los genes HLA-A, HLA-B y HLA-C.
- MHC Clase II: Se expresa principalmente en células presentadoras de antígenos profesionales (macrófagos, células dendríticas y linfocitos B). Presenta péptidos exógenos (procedentes de patógenos fagocitados) a los linfocitos T cooperadores (CD4⁺), activando la respuesta inmune adaptativa. Está codificado por los genes HLA-DP, HLA-DQ y HLA-DR en humanos.
- MHC Clase III: No participa directamente en la presentación antigénica, pero desempeña un papel en la inmunidad innata y la inflamación. Incluye genes que codifican componentes del sistema del complemento (C2, C4, factor B), citocinas como el TNF-α y proteínas de respuesta al estrés. Menor implicación en la histocompatibilidad relacionada con trasplante.
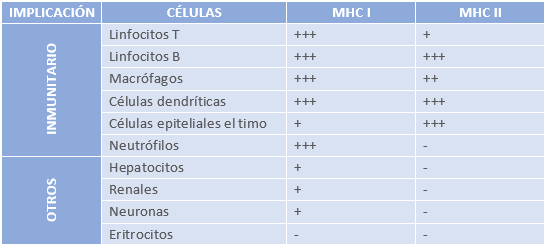
Tabla 2: Expresión de moléculas MHC en función del tipo celular
Las moléculas de histocompatibilidad se descubrieron como un locus génico (región del cromosoma) responsable del rechazo en trasplantes. Estos experimentos fueron llevados a cabo por Snell, quien observó que había un locus que, cuando era común a los ratones en los que hacía injertos, no producía rechazo del trasplante.
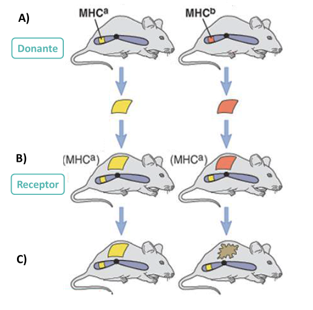
Ilustración 19: Experimento de Snell. A) A partir de un ratón donante (MHC a/b) se extrae tejido de piel. B) A un receptor MHC b se le injerta piel del donante a o b. C) Trasplante exitoso o rechazo, según carga genética
Una de las características de las moléculas del MHC es que son altamente polimórficas, es decir, existe multitud de variantes alélicas codificadas por el mismo gen. Son las moléculas más polimórficas que existen. En la clase I, el gen HLA-B es el más polimórfico; y en la clase II, el más polimórfico sería el HLA-DR.
El polimorfismo en el HLA se debe a la gran cantidad de alelos distintos que existen para cada uno de los genes que lo conforman, principalmente los HLA de clase I (HLA-A, HLA-B y HLA-C) y los HLA de clase II (HLA-DR, HLA-DQ y HLA-DP). Cada persona hereda un conjunto de alelos del HLA de cada progenitor, lo que da lugar a una enorme diversidad genética en la población.
Debido al alto grado de polimorfismo -a fecha de 2025, se conocen por encima de 35000 alelos distintos para HLA-, encontrar un donante con un HLA idéntico al del receptor es difícil, excepto en gemelos monocigóticos. Cuanto mayor sea la compatibilidad entre los alelos del HLA del donante y el receptor, menor será el riesgo de rechazo del injerto.
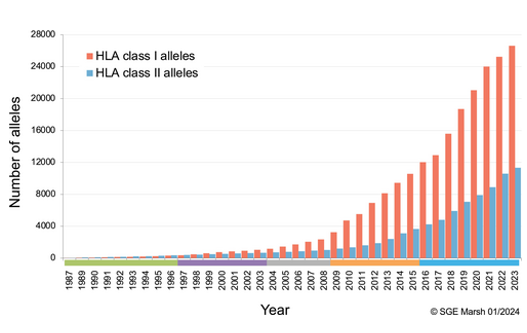
Ilustración 20: Número total de alelos para HLA I (en rojo) y HLA II (en azul) a fecha de 2023. Fuente: Robinson J et al. 2024; disponible en: https://onlinelibrary.wiley.com/doi/10.1111/tan.15549
En los trasplantes de órganos sólidos (como el riñón o el hígado), se intenta maximizar la compatibilidad del HLA-A, HLA-B y HLA-DR, ya que son los loci más inmunogénicos. Cada vez hay mayor tendencia a considerar DQ y C.
Es importante recordar que, al contrario que ocurre con los grupos sanguíneos, no estamos preinmunizados de forma genética, sino que es la exposición a ciertos factores (embarazo, trasfusiones, trasplantes previos…) la que puede generar una sensibilización a determinados HLA.
Tal es el polimorfismo de estas moléculas que ha sido necesario crear un sistema de nomenclatura específico, compuesto por cuatro números separados por dos puntos “:”, de forma que si los cuatro primeros números de dos alelos distintos coinciden, quiere decir que ambos presentan la misma secuencia de aminoácidos, pero que pueden estar sometidos a mutaciones sinónimas. Un alelo HLA típico se representa de la siguiente manera:
HLA-A*02:101:01:02L
Donde cada sección indica:
- Locus (HLA-A) → Representa la clase y el gen en el que se encuentra el alelo. Puede ser HLA-A, HLA-B, HLA-C (clase I) o HLA-DR, HLA-DQ, HLA-DP (clase II).
- Grupo alélico (02) → Define el grupo principal de alelos con similitudes estructurales y funcionales.
- Subtipo (101) → Indica diferencias en la secuencia de aminoácidos dentro del mismo grupo alélico.
- Variante específica (01) → Identifica diferencias en la secuencia de ADN sin cambios en la estructura proteica.
- Modificación funcional (02L) → Letras finales opcionales que indican características funcionales:
- N → Alelo no funcional (nulo, no se expresa).
- L → Baja expresión del antígeno.
- S → Expresión secretable.
- Q → Expresión dudosa o incierta.
- C → Expresión solo en células específicas.
Para mostrar la importancia que tiene la compatibilidad de HLA entre donante y receptor, vamos a mostrarlo en las siguientes gráficas.
En la primera de ellas, la gráfica muestra la supervivencia del injerto renal a 10 años en un estudio multicéntrico que recoge decenas de miles de pacientes trasplantados, agregándolos en función del número de incompatibilidades de HLA. Cuanto mayor es el número de incompatibilidades (máximo 6) peor es la supervivencia el injerto.
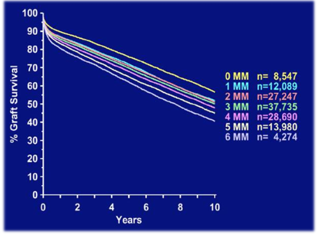
Ilustración 21: Supervivencia del injerto a 10 años según el número de incompatibilidades (MM). Fuente: López-Hoyos M et al, 2021; disponible en: https://nefrologiaaldia.org/es-articulo-inmunobiologia-del-trasplante-estudios-inmunologicos-del-donante-y-del-146
Por otro lado, nos encontramos un estudio aún más longevo donde no solo demuestra los valores brutos de incompatibilidades, sino también en función del tipo de desigualdades HLA. La supervivencia de los injertos renales depende, de manera primordial, de la compatibilidad entre donante y receptor de los antígenos HLA clase II. La compatibilidad o incompatibilidad de los antígenos clase I tiene un efecto menor sobre la supervivencia de los injertos, a menos que haya también incompatibilidad entre los antígenos de clase II. Se observa una tasa de supervivencia a dos años de 90% en los casos de trasplante renal en los que son incompatibles uno o dos de los loci HLA clase I, mientras que los riñones trasplantados con diferencias en los MHC clase II tienen una posibilidad de sólo 70% de durar dos años. Los que tienen números más elevados de desigualdades experimentan tasas de supervivencia mucho más bajas al año del trasplante.
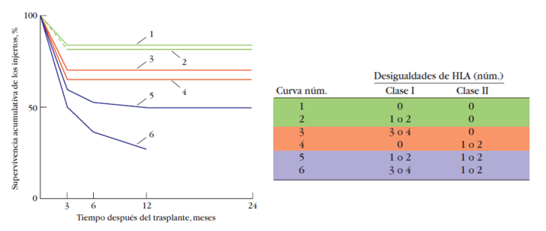
Ilustración 22: Efecto de al compatibilidad entre los antígenos HLA de clases I y II sobre la supervivencia de injertos renales. A la izquierda, curva de supervivencia; a la derecha, datos desagregados. Fuente: Moen T et al, 1980; disponible en: https://pubmed.ncbi.nlm.nih.gov/6997739/
2.2 Estudio de compatibilidad
Antes de empezar a determinar las características de donante y receptor, vamos a concluir con las pruebas diagnósticas que se llevan a cabo para asegurar que el componente inmunológico no va a ser un hándicap al trasplantar al paciente. Para ello, la inclusión de los pacientes en lista de espera supone un estudio detallado de dos componentes principales: el tipaje del HLA y la presencia de anticuerpos contra HLA distintos al propio.
2.2.1 Tipaje HLA
La tipificación de HLA es fundamental para evaluar la compatibilidad entre donante y receptor en trasplantes de órganos. Históricamente, la tipificación se realizaba mediante la denominada Prueba de Terasaki: La prueba de microlinfocitotoxicidad de Terasaki (citotoxicidad dependiente del complemento, CDC) es la prueba básica para los estudios serológicos en el trasplante, tanto para el tipaje HLA como para la detección de anticuerpos anti-HLA en el suero del receptor. Para su realización, se extrae sangre del posible receptor y se aíslan los linfocitos, para posteriormente incubarlos en una placa de 60 multipocillos donde se colocaban junto a sueros de anticuerpos específicos contra los distintos HLA conocidos incubando aproximadamente 45 minutos; posteriormente se añade complemento (de conejo) y se vuelve a incubar por el mismo tiempo (algo más). Tras añadir un colorante capaz de intercalar el ADN es posible, a su visualización, detectar si ha habido lisis celular de linfocitos, es decir, si los anticuerpos del receptor han detectado el HLA del donante, han permitido la formación del complejo inmunológico junto al complemento posteriormente añadido, y han provocado la lisis celular. Aquellos pocillos que den resultado positivo (los linfocitos del paciente se ven lisados y teñidos en su interior) nos determinan el HLA del receptor.
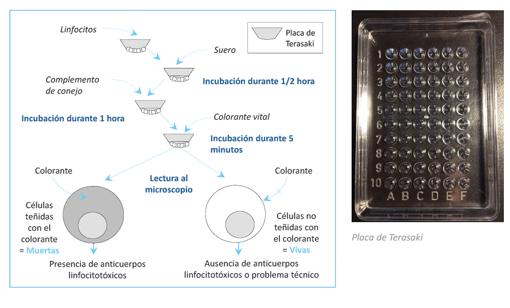
Ilustración 23: Método de Terasaki para el tipaje HLA. Fuente: López-Hoyos M et al, 2021; disponible en: https://nefrologiaaldia.org/es-articulo-inmunobiologia-del-trasplante-estudios-inmunologicos-del-donante-y-del-146
Hoy en día se realiza mediante técnicas serológicas y moleculares, siendo las técnicas basadas en ADN, como la secuenciación de alto rendimiento, las más precisas y detalladas. La tipificación molecular de alta resolución permite identificar alelos específicos que pueden no ser detectados por métodos serológicos tradicionales, mejorando así la precisión en la evaluación de la compatibilidad inmunológica. La Kidney Disease Outcomes Quality Initiative (KDOQI) recomienda la tipificación HLA de los candidatos a trasplante utilizando métodos moleculares en todos los loci relevantes.
La secuenciación de nueva generación (NGS) ha revolucionado la tipificación HLA al permitir la secuenciación de múltiples loci HLA simultáneamente con alta precisión. Este método implica la amplificación de regiones específicas del ADN mediante PCR, seguida de la secuenciación masiva de los productos amplificados. La NGS ofrece una resolución de hasta tres campos, lo que permite la identificación de variantes nucleotídicas específicas dentro de los alelos HLA.
Con la metodología de la reacción en cadena de la polimerasa (polymerase chain reaction, PCR) es posible definir un mayor número de especificidades y con mayor grado de resolución en trasplante que con los métodos serológicos. Aunque esto no pareciera tener una gran utilidad en el trasplante renal, puesto que se emplea un nivel de resolución bajo (con dos dígitos es suficiente), hoy en día se propone el estudio incluso de cuatro dígitos para aquellos pacientes hipersensibilizados. En definitiva, estas técnicas moleculares destacan por su rapidez, sencillez y reproducibilidad.
2.2.2 Detección de anticuerpos anti-HLA
Como comentábamos anteriormente, la aparición de anticuerpos anti-HLA es, en la mayoría de los casos, consecuencia de transfusiones sanguíneas (o de derivados), embarazos (o abortos) o trasplantes previos fracasados. Cuando el suero del receptor reacciona contra más del 50-75% de los linfocitos del panel se considera que el paciente está hiperinmunizado, una situación que marca significativamente el pronóstico de un futuro trasplante. Estos pacientes tienen menos posibilidades de trasplantarse (es decir, de encontrar un donante en el que la prueba cruzada sea negativa), menor supervivencia del injerto en caso de realizarse un trasplante y menor supervivencia del paciente. Dada la importancia de esta situación, se precisa una evaluación periódica del suero de los posibles receptores en busca de estos anticuerpos, así como estudios adicionales tras estímulos antigénicos, fundamentalmente transfusiones sanguíneas.
Tradicionalmente, la detección se ha realizado mediante la técnica de microlinfotoxicidad de Terasaki que comentamos arriba para el tipaje. En este caso, el suero del paciente se enfrentaba a un panel de unas 30-60 muestras representativas de la población general. A mayor porcentaje de reactividad contra el panel, mayor aumento del PRA, antes comentado, que podríamos definir como el porcentaje de individuos de una población contra el que el paciente receptor tiene anticuerpos anti HLA, por lo que su trasplante no está indicado.
Sin embargo, los avances tecnológicos han permitido ensayos mucho más eficientes, como son las pruebas en fase sólida. Estos métodos, como los basados en perlas de Luminex, han revolucionado la detección de anticuerpos anti-HLA debido a su alta sensibilidad y especificidad. Estos ensayos utilizan perlas recubiertas con antígenos HLA específicos y permiten la detección simultánea de múltiples anticuerpos en una sola muestra de suero. La tecnología Luminex es considerada el gold-standard en la detección de anticuerpos anti-HLA debido a su capacidad para detectar incluso anticuerpos a muy baja concentración que podrían no ser detectados por métodos tradicionales.
Para llevarla a cabo, se recolecta el suero del paciente y se incuba con nanopartículas (perlas, “beads”) que tienen antígenos HLA específicos; tras permitir la unión (tras incubación, lo que no se une se lava), se añade un anticuerpo secundario marcado con un fluorocromo que se une a los anticuerpos anti-HLA unidos a las perlas. La fluorescencia se mide utilizando un citómetro de flujo, y la intensidad de la fluorescencia (MFI) se correlaciona con la cantidad de anticuerpos presentes. La interpretación es sencilla: a mayor fluorescencia (MFI), mayor cantidad de anticuerpos y mayor riesgo pues de rechazo del injerto.
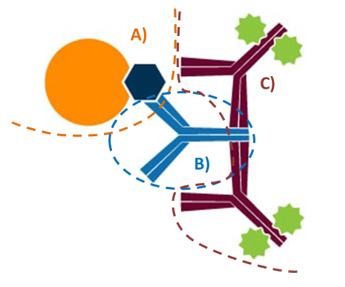
Ilustración 24: Esquema de ensaño Luminex. A) HLA con bead; B) Anticuerpo del paciente unido a HLA; C) Anticuerpos secundarios con molécula fluorescente. Fuente: modificado de Jackson Immuno; disponible en: https://www.jacksonimmuno.com/secondary-antibody-resource/immuno-techniques/popular-bead-based-multiplex-assay/
En realidad el resultado que aporta Luminex no es dicotómico (negativo/positivo) y depende en gran medida de condiciones del laboratorio. Habitualmente, se considera positivo un MFI superior a 1500. A pesar de este problema aún por resolver, el Luminex se ha convertido hoy en día en el estándar en la mayoría de los laboratorios de histocompatibilidad. El Luminex permite conocer de forma muy detallada cuales son las especificidades antigénicas contra las que reacciona el receptor (antígenos prohibidos) y cuales contra las que no reacciona (antígenos permitidos), definiendo muy claramente qué donantes podrían ser compatibles con el receptor a priori, incluso antes de hacer la prueba cruzada.
2.2.3 Prueba cruzada
Las pruebas cruzadas evalúan la presencia de anticuerpos preformados en el receptor que reaccionan contra los antígenos del donante. La técnica tradicional de CDC (Terasaki) sigue siendo un estándar, aunque tiene limitaciones en sensibilidad. En este caso, lo que se incuba son anticuerpos del donante (de sangre periférica, bazo) de la cual se extraen los linfocitos y suero del receptor, el cual tiene (si los tuviera, claro) los anticuerpos. Así, se produce la incubación, para añadir posteriormente el complemento. La interpretación es similar a la que hemos dado anteriormente. En resumen:
- Resultado positivo: Indica la presencia de anticuerpos preformados en el suero del receptor que son específicos para los antígenos HLA del donante. Esto sugiere un alto riesgo de rechazo hiperagudo del injerto. En este caso, se debe considerar un donante alternativo o estrategias de desensibilización.
- Resultado negativo: Indica la ausencia de anticuerpos preformados específicos para los antígenos HLA del donante, sugiriendo una menor probabilidad de rechazo hiperagudo.
Sin embargo, el método más sensible es la realización de la prueba cruzada por citometría de flujo, capaz de detectar anticuerpos en títulos muy bajos y anticuerpos que no activen el complemento. Similar a lo que hemos comentado anteriormente para la tecnología Luminex, tras la incubación entre suero del receptor (con anticuerpos) y linfocitos del donante (con HLA) y su lavado correspondiente para eliminar no unión, se añade un anticuerpo que reconozca dicha unión con un fluorocromo que permita generar una señal de fluorescencia (MIF).
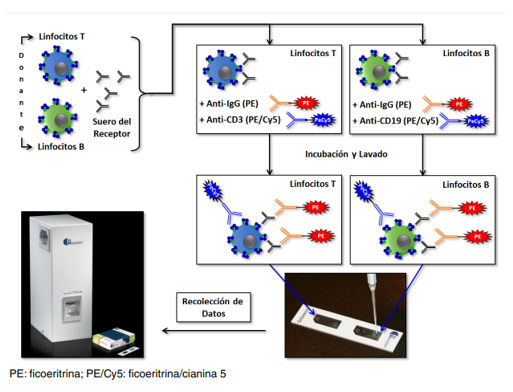
Ilustración 25: Protocolo de la prueba cruzada por citometría de imagen de dos colores (en este caso, para reconocer linfocitos T -CD3- y linfocitos B -CD19-). Fuente: Arrunategui AM et al, 2022; disponible en: https://revistabiomedica.org/index.php/biomedica/article/view/6255
La prueba cruzada virtual (PCV) es una técnica moderna utilizada para evaluar la compatibilidad entre donante y receptor antes del trasplante, sin necesidad de realizar un crossmatch físico. Esta técnica se basa en la tipificación completa de HLA del donante y la evaluación actual de anticuerpos del receptor, obteniendo una comparativa de datos inmediata, permitiendo decisiones rápidas y precisas en el proceso de trasplante. La PCV es una prueba tremendamente rápida, ya que puede realizarse en cuestión de minutos y reducir el tiempo de isquemia del órgano; tienen una sensibilidad y especificidad mayor que CDC; y además reduce considerablemente el coste al ahorrar otras muchas pruebas cruzadas manuales. Sin embargo, hay que recordar que su utilidad es el ahorrar tiempo y recursos, pero nunca sustituir una prueba cruzada física.
2.2.4 Algoritmo de decisión
A partir de los resultados obtenidos en las pruebas de compatibilidad realizadas, podemos extraer un algoritmo de decisión para facilitar la comprensión de si el trasplante debe darse o no entre ese donante y receptor. A modo de resumen, el esquema sería:
- Compatibilidad de grupo sanguíneo: La primera consideración es la compatibilidad ABO entre donante y receptor. En caso de incompatibilidad, el trasplante está contraindicado.
- Historial de sensibilización previa: Se debe evaluar si el receptor ha recibido previamente un trasplante de un donante con alguna incompatibilidad similar. En estos casos, existe el riesgo de una sensibilización inmunológica previa, incluso si en el momento actual no se detectan anticuerpos. Debido a la posibilidad de memoria inmunológica, se recomienda evitar el trasplante.
- Antígeno A2 en el donante: Se desaconseja el trasplante si el donante expresa el antígeno A2 y el receptor no lo posee, debido a la alta inmunogenicidad de este antígeno. En caso de rechazo del injerto, la sensibilización contra A2 reduciría significativamente las posibilidades de un segundo trasplante.
- Compatibilidad HLA: Se recomienda una compatibilidad HLA lo más alta posible, siendo especialmente relevante la coincidencia en el locus DR (y, en menor medida, DQ), ya que estos loci están más relacionados con la evolución del injerto a largo plazo.
- Presencia de anticuerpos anti-HLA y pruebas de compatibilidad: Si el receptor presenta anticuerpos anti-HLA, se realiza una prueba cruzada virtual (PCv) para predecir el resultado de la prueba cruzada por citotoxicidad dependiente de complemento (CDC).
- Si ambas pruebas (PCv y CDC) son negativas, el trasplante es viable.
- Si la PCv es negativa y la CDC es positiva, aunque esta situación es poco común, se recomienda no proceder con el trasplante y analizar las posibles causas, como la presencia de anticuerpos no detectados en la PCv (anti-C, anti-DQ, anti-DP).
- Si la PCv es positiva, es altamente probable que la CDC también lo sea, en cuyo caso el trasplante estaría contraindicado. En casos donde la PCv sea positiva pero la CDC negativa, esto podría deberse a niveles bajos de anticuerpos contra el donante. En estas situaciones, se recomienda realizar una prueba cruzada por citometría de flujo (PC-CF), que es más sensible.

Tabla 3: Algoritmo de decisión según resultados de PCV y CDC
- PC-CF es positiva, indica sensibilización; se recomienda no trasplantar.
- PC-CF es negativa, considerar el trasplante, a pesar de una PCv positiva.
En ausencia de la posibilidad de realizar una PC-CF, la opción más prudente sería no trasplantar y seleccionar otro receptor.
Estos criterios garantizan la máxima compatibilidad inmunológica y reducen el riesgo de rechazo del injerto, optimizando los resultados a largo plazo en los pacientes trasplantados.
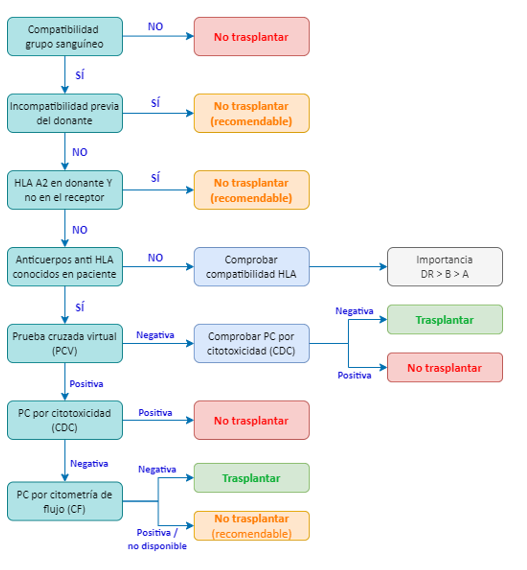
Ilustración 26: Algoritmo de decisión de trasplante
2.3 Evaluación del receptor
El trasplante renal es la opción terapéutica de elección para pacientes con enfermedad renal crónica en estadio terminal, ya que ofrece una mejor calidad de vida y mayor supervivencia en comparación con la terapia sustitutiva mediante diálisis. Sin embargo, la demanda de órganos supera ampliamente la disponibilidad de donantes, lo que hace imprescindible la existencia de criterios rigurosos para la inclusión en lista de espera.
La selección de receptores se basa en un análisis multidimensional que incluye aspectos clínicos, inmunológicos y psicosociales. Los criterios de inclusión tienen como objetivo garantizar que los candidatos puedan beneficiarse del trasplante, minimizando riesgos y optimizando el uso de los recursos disponibles. Factores como la expectativa de vida, la presencia de comorbilidades, el estado funcional del paciente y su adherencia al tratamiento son determinantes en este proceso.
Además, la compatibilidad inmunológica y la evaluación de anticuerpos preformados juegan un papel crucial en la reducción del riesgo de rechazo. En paralelo, se consideran aspectos éticos y de equidad, priorizando a los pacientes según criterios objetivos y transparentes. Esta rigurosa selección busca maximizar los resultados a largo plazo y garantizar la eficiencia del programa de trasplante renal.
A continuación, iremos desarrollando los distintos criterios para la inclusión del paciente en la lista de espera de trasplante renal.
2.3.1 Evaluación general
Antes de tener en cuenta el historial médico en cuanto a los antecedentes cardiovasculares, oncológicos o pulmonares, entre otros, es necesario hacer una valoración de cuestiones que a priori podrían ser más básicas pero que, sin embargo, condicionan su realización. Son:
Peso, talla, IMC
En pacientes con obesidad (IMC entre 30 y 35 kg/m²), no se ha demostrado un impacto negativo significativo en el pronóstico tras el trasplante renal. No obstante, se recomienda la reducción de peso mediante medidas dietéticas y actividad física. Por el contrario, la obesidad mórbida (IMC superior a 35 kg/m²) se asocia con un aumento considerable del riesgo de complicaciones quirúrgicas, retraso en la función del injerto, episodios de rechazo agudo, así como una mayor tasa de fracaso tanto precoz como tardío del trasplante, lo que afecta negativamente a la supervivencia del paciente y del injerto. Ante este escenario, la estrategia para la pérdida de peso debe ser más estricta. A pesar de estos riesgos, la obesidad mórbida no constituye una contraindicación absoluta para el trasplante renal, siendo la valoración del cirujano un factor determinante en la decisión final.
Edad
La edad del receptor no debe considerarse un criterio excluyente para el trasplante renal. No obstante, muchas contraindicaciones relativas, especialmente las de origen cardiovascular, son más frecuentes en pacientes de mayor edad. Por este motivo, se reconoce que la mayoría de los candidatos menores de 50 años, sin antecedentes de enfermedad cardiovascular, sin diabetes, con adecuada condición física, con un tiempo en diálisis inferior a dos años y sin historia familiar de patología cardiovascular, pueden acceder al trasplante sin restricciones. En cambio, aquellos de edad avanzada o con comorbilidades deben ser evaluados de manera individualizada.
Es fundamental realizar una valoración detallada de la enfermedad cardiovascular, un cribado oncológico riguroso y un análisis del estado funcional y psicosocial del paciente. A pesar de que los receptores mayores de 70 u 80 años tienen una mayor incidencia de complicaciones cardiovasculares e infecciosas en comparación con los más jóvenes, el trasplante renal sigue proporcionando una mejor supervivencia y calidad de vida que la diálisis. Sin embargo, no existen guías establecidas que definan con precisión las pruebas diagnósticas necesarias ni la frecuencia con la que deben repetirse en pacientes que permanecen en lista de espera sin recibir el trasplante.
Por otro lado, no existe una edad mínima para recibir un trasplante, pero la experiencia en menores de 1 año es escasa y en casi todos los centros se aconseja un peso superior a 10 Kg en el receptor.
Fragilidad
Debido al incremento de la morbimortalidad asociada al trasplante renal y a la fragilidad en pacientes de diálisis, y más aún de edad avanzada, debería evaluarse detenida e individualmente la idoneidad del paciente para ser trasplantado. Por sí misma la fragilidad física no es un impedimento para el trasplante, pero al asociarse a complicaciones cardiovasculares el hándicap será mayor.
Enfermedad renal de base
Es importante minimizar o evitar el tiempo en diálisis y favorecer el TR anticipado. Numerosas nefropatías, principalmente autoinmunes, pueden reaparecer tras el trasplante renal, aunque en la mayoría de los casos su impacto clínico es limitado y solo en menos del 5% de los pacientes provoca la pérdida del injerto. Ante la sospecha de recidiva de la enfermedad original, es fundamental realizar una biopsia del injerto para confirmar el diagnóstico. Además, el momento óptimo para el trasplante puede variar según la patología subyacente, por lo que es necesario considerar diversos factores antes de la intervención. Tendremos en cuentas las siguientes consideraciones:
- Enfermedad por anticuerpos antimembrana basal y vasculitis ANCA: Se recomienda retrasar el trasplante al menos seis meses, hasta la negativización de los anticuerpos.
- Lupus eritematoso sistémico: El trasplante debe realizarse cuando la enfermedad esté en quiescencia con dosis bajas de esteroides. Se aplica el mismo criterio para la púrpura de Schönlein-Henoch, la granulomatosis con poliangeítis y la esclerodermia.
- Glomeruloesclerosis focal primaria: Alto riesgo de recurrencia, especialmente en formas agresivas y en pacientes con recidiva en trasplantes previos. No contraindica el trasplante, pero se debe informar al paciente y al donante si es de vivo.
- Síndrome de Alport: Algunas mutaciones pueden aumentar el riesgo de enfermedad antimembrana basal. Se recomienda estudio genético previo si es posible.
- Síndrome hemolítico urémico atípico (SHUa): Elevada tasa de recurrencia y pérdida del injerto, especialmente en mutaciones del complemento.
- Nefropatía IgA y glomerulonefritis membranoproliferativa: Alta tasa de recurrencia (hasta 80%), pero la pérdida del injerto por esta causa es menor del 20%. No se recomienda nefrectomía de los riñones nativos.
- Enfermedad de Fabry: Los pacientes pueden ser trasplantados, manteniéndolos con terapia enzimática sustitutiva.
Acceso y terapia renal sustitutiva
Los pacientes de hemodiálisis que se realizan su tratamiento a través de catéter venoso central sufren mucho más riesgo de presentar infección aguda en el acceso, por lo que podría retrasarse su trasplante en caso de ser candidato, ya que el riesgo de sepsis y endocarditis es alto. Más aún, pacientes portadores de catéter femoral presentan riesgo aumentado de trombosis venosa, por lo que sería importante comprobar el estado vascular mediante una flebografía de miembros inferiores.
En el caso de peritonitis derivada de la diálisis peritoneal, el paciente será excluido temporalmente hasta 4 semanas tras su tratamiento. Entre las pruebas diagnósticas a recoger está el recuento celular de líquido peritoneal en el momento de alerta de trasplante. El catéter peritoneal debería ser retirado durante la intervención quirúrgica.
Inmunización
El calendario de vacunación debe estar actualizado en el momento del trasplante renal (TxR). Las vacunas infantiles deben seguir el calendario vigente en la región local. Las vacunas con virus vivos atenuados solo deben administrarse antes del trasplante, mientras que las vacunas con virus inactivados pueden administrarse tanto antes como después del trasplante. Es necesario esperar al menos un mes después de recibir una vacuna con virus vivos atenuados para proceder con el trasplante.
Se recomienda la vacunación contra hepatitis B, neumococo, Haemophilus, meningococo y tétanos-difteria, así como la anual contra gripe estacional, revacunaciones contra neumococo, difteria-tétanos y hepatitis H, triple vírica, y Sars-CoV-2, entre otros. Es recomendable que el paciente mantenga su calendario de vacunación actualizado y lo lleve consigo.
Además, es importante esperar un mes después de la vacunación con virus vivos atenuados antes del trasplante. Si la vacuna es de virus inactivados, no es necesario esperar, pero se recomienda que hayan transcurrido al menos 15 días desde la vacunación para asegurar la inmunización del paciente.
Tabaquismo, alcoholismo y consumo de drogas
El consumo de tabaco, alcohol y sustancias psicoactivas es un factor crítico en la evaluación de candidatos para el trasplante renal, dado su impacto en la adherencia al tratamiento y en los resultados postrasplante.
El tabaquismo se asocia con un mayor riesgo de pérdida del injerto, mortalidad prematura y desarrollo de neoplasias. Sin embargo, los estudios indican que estos riesgos se reducen significativamente tras cinco años de abstinencia, lo que refuerza la importancia de su cesación antes del trasplante.
El consumo excesivo de alcohol incrementa la probabilidad de pérdida del injerto y mortalidad postrasplante. Por ello, se recomienda un mínimo de un año de abstinencia y adherencia estricta al tratamiento dialítico antes de la inclusión en lista de espera. Además, es aconsejable la evaluación por un equipo especializado y, en caso necesario, la incorporación a un programa de deshabituación.
Los pacientes con antecedentes de consumo de drogas no son automáticamente excluidos del trasplante, pero su evaluación es individualizada. Las guías KDOQI y KDIGO establecen que los pacientes con trastornos de uso de sustancias activos y no controlados pueden no ser aptos debido al riesgo de no adherencia y malos resultados clínicos. En la práctica, se exige al menos un año de abstinencia documentada y compromiso con el tratamiento. En el caso de la marihuana, aunque no hay consenso claro sobre su exclusión, se ha observado un mayor riesgo de aspergilosis pulmonar grave al inhalarla, así como un incremento del riesgo de hipotensión, enfermedad cardiovascular y posibles interacciones con los inhibidores de la calcineurina.
2.3.2 Antecedentes clínicos y enfermedades asociadas
Las patologías de base y los antecedentes clínicos son determinantes en la selección de receptores para el trasplante renal, ya que influyen en la supervivencia del injerto y del paciente. Enfermedades como diabetes, enfermedad cardiovascular o antecedentes de neoplasias requieren una evaluación exhaustiva para minimizar riesgos. A continuación repasaremos los antecedentes a considerar más importantes:
Antecedentes cardiovasculares
La enfermedad cardiovascular representa la principal causa de mortalidad tanto precoz como tardía en pacientes con trasplante renal, lo que hace imprescindible una evaluación pretrasplante rigurosa. Sin embargo, la falta de consenso en las prácticas clínicas y la escasez de evidencia de alto nivel dificultan la estandarización de recomendaciones.
Todos los candidatos deben someterse a una radiografía de tórax para detectar cardiomegalia y a un electrocardiograma (ECG) para evaluar hipertrofia ventricular izquierda (HVI), isquemia o arritmias. Aunque no se recomienda realizar un ecocardiograma sistemático, sí es aconsejable en pacientes mayores de 50 años o en aquellos con hallazgos sugestivos en las pruebas iniciales.
No existe un criterio uniforme sobre la necesidad de pruebas de esfuerzo o estrés cardíaco en todos los pacientes, aunque la ecografía con estrés-dobutamina parece ser la opción más rentable. Se recomienda la detección de lesiones coronarias en pacientes con antecedentes de cardiopatía isquémica o diabetes, complementándose con coronariografía en caso de hallazgos sugestivos. La presencia de síntomas de cardiopatía isquémica suele indicar la necesidad de una coronariografía directa. El paciente será excluido de la lista de espera si ha sufrido un infarto agudo de miocardio en los últimos seis meses, presenta angina progresiva o no es posible una evaluación cardiológica adecuada ni una intervención correctora ante una prueba no invasiva positiva.
La presencia de enfermedad vascular periférica se asocia a mayor riesgo de mortalidad tanto en lista de espera como tras el trasplante renal. Además, la presencia severa de ateromas en aortoilíaca puede complicar la implantación del injerto, especialmente en pacientes diabéticos, y a largo plazo aumentar el riesgo de amputación. Por ello, los candidatos con síntomas de claudicación, signos evidentes de isquemia periférica o calcificaciones vasculares avanzadas deben someterse a estudios de imagen, como angioTAC o angiografía completa, que incluyan la evaluación de la circulación distal. En caso de detectar lesiones significativas, se recomienda realizar una corrección quirúrgica o angioplastia electiva antes de su inclusión en la lista de espera.
Diabetes mellitus
La diabetes mellitus en receptores de trasplante renal puede ser preexistente o desarrollarse después del trasplante, conocida como diabetes postrasplante. Ambas formas afectan significativamente los resultados del trasplante y su manejo, pues se asocia con un mayor riesgo de fallo del injerto, enfermedad cardiovascular y mortalidad. Además, el riesgo de mortalidad postrasplante está incrementado, debido a complicaciones cardiovasculares y de infecciones. Finalmente, la diabetes también se asocia con peores resultados a largo plazo, aunque su impacto puede ser menos si la condición aparece tras el trasplante que cuando es una patología de base.
El manejo de la diabetes se realiza mediante insulina en el entorno intrahospitalario y esta puede mantenerse tras el ingreso. Además, la metformina también podrá ser usada con criterios de filtrado glomerular similares a la diabetes tipo 2, pues sus efectos adversos están directamente relacionados con la función renal.
Antecedentes respiratorios-pulmonares
La información sobre el despistaje de enfermedades pulmonares antes del trasplante renal es limitada, pero estas condiciones están asociadas con un mayor riesgo de pérdida del injerto y muerte del paciente.
Como comentaremos posteriormente en las pruebas diagnósticas, es imprescindible realizar una radiografía de tórax a todos los pacientes para evaluar el parénquima pulmonar. En aquellos que son fumadores, mayores de 60 años o que presenten síntomas indicativos de bronconeumopatía crónica, se deben realizar pruebas funcionales respiratorias. Si las pruebas funcionales muestran alteraciones (como un FEVI <80%, con o sin síntomas), se debe consultar con el servicio de anestesia antes de continuar.
Es necesario descartar la presencia de hipertensión pulmonar (HTP) mediante ecocardiografía. La HTP se define como una presión sistólica en el ventrículo derecho (VD) superior a 45 mmHg. Esta condición es común en pacientes con enfermedad renal crónica terminal (ERCT) y se asocia con insuficiencia cardiaca, sobrecarga secundaria a fístulas arteriovenosas (FAV) y tabaquismo. Se recomienda confirmar la HTP mediante cateterismo derecho (HTP se considera cuando la presión media en la arteria pulmonar es superior a 25 mmHg). Si no se identifican causas secundarias como insuficiencia cardíaca derecha, se debe remitir al paciente a un especialista con experiencia en este campo, y se sugiere el uso de terapia vasodilatadora. Si la HTP es moderada a severa y no responde adecuadamente al tratamiento, el paciente no es considerado candidato a trasplante renal.
Según las Guías de la Sociedad Canadiense de Trasplante, los siguientes pacientes son excluidos de su condición de candidatos a trasplante renal:
- Pacientes que requieren oxigenoterapia domiciliaria.
- Aquellos con asma incontrolada.
- Pacientes con cor pulmonale severo o hipertensión pulmonar severa irreductible.
- Pacientes con EPOC grave, enfermedad restrictiva pulmonar o fibrosis pulmonar, definida por un volumen espiratorio forzado en el primer segundo (FEV1) < 25% del valor predicho o una PO2 en aire ambiente < 60 mmHg.
Antecedentes digestivos
Uno de los principales hándicap que aparecen es la existencia de patología hepática crónica secundaria a infección (veremos más adelante). Ambas condiciones son contraindicaciones relativas para el trasplante. Los pacientes con hepatitis B o C deben ser tratados y evaluados por un hepatólogo antes del trasplante. Si el grado de fibrosis hepática o cirrosis es avanzado (según biopsia o datos clínicos), se debe considerar el trasplante hepatorrenal combinado.
Otras consideraciones a tener en el caso del trasplante renal ante distintas patologías son:
- Colelitiasis: En pacientes con antecedentes de colecistitis aguda o en diabéticos (quienes tienen una alta prevalencia de colelitiasis), se debe considerar la realización de colecistectomía antes del trasplante. Sin embargo, no se realiza colecistectomía profiláctica en la actualidad.
- Úlcera péptica: Los pacientes con úlcera péptica activa, incluyendo aquellos infectados por Helicobacter pylori, deben ser tratados de manera activa antes del trasplante, y la curación de la enfermedad debe ser confirmada mediante endoscopia.
- Enfermedad diverticular de colon: Los pacientes con sospecha de haber tenido un episodio previo de enfermedad diverticular deben someterse a evaluación mediante enema opaco o colonoscopia. No se recomienda realizar un screening de diverticulosis en ausencia de antecedentes. Después del trasplante, se deben evitar las resinas intercambiadoras.
- Pólipos de colon y Enfermedad Inflamatoria Intestinal (EII): En estos casos o cuando exista un alto riesgo de cáncer de colon (por ejemplo, antecedentes familiares), se debe realizar colonoscopia periódica según las guías de población general.
Por otro lado, el trasplante renal es compatible con un historial de cirugía abdominal, aunque existen ciertos riesgos adicionales que deben ser considerados. Los pacientes con antecedentes de cirugía abdominal pueden tener un mayor riesgo de complicaciones intraabdominales después del trasplante renal, como la presencia de seromas, dehiscencia, patología vascular y urogenital, e incluso fracaso en el trasplante y aumento de la mortalidad, al tiempo que las estancias hospitalarias eran más prolongadas y el número de reintervenciones también era superior. El tiempo recomendado entre una cirugía abdominal y un trasplante renal depende de varios factores, incluyendo la naturaleza de la cirugía abdominal y la condición clínica del paciente. En general, se recomienda un período de espera de al menos 4 semanas después de una intervención quirúrgica mayor, como una cirugía abdominal, para permitir una recuperación adecuada y minimizar el riesgo de complicaciones postoperatorias, aunque este período puede verse incrementado dependiendo de la complejidad de la cirugía y la recuperación del paciente.
Antecedentes oncológicos
Una neoplasia activa, con excepción del cáncer cutáneo no melanoma, constituye una contraindicación absoluta para el trasplante, a excepción del cáncer de próstata con un puntaje de Gleason ≤ 6 (bajo riesgo) y el tumor renal incidental con un diámetro máximo ≤ 1 cm.
Es importante tener en cuenta (como veremos cuando lleguemos al apartado de fármacos relacionados con el trasplante renal) que la inmunosupresión favorece el crecimiento de las células malignas, lo que puede resultar en una supervivencia reducida del paciente trasplantado y opciones de tratamiento limitadas. Por ello, en pacientes mayores en diálisis, es importante investigar la posible presencia de neoplasias ocultas, para lo que se recomienda la realización de screening con consideraciones similares a las de la población general: sangre oculta en heces, marcadores biológicos como PSA, s/a infecciones como hepáticos o de cérvix, mamografía…
Por tanto, a modo de resumen
- Incluidos en lista de espera: pacientes sometidos a tratamiento curativo con Ca basocelular o epidermoide de piel, melanoma y Ca cervix in situ, tiroides, renal inferior a 3 cm extirpado con éxito, Ca próstata con Gleason score ≤ 6 y Ca superficial de vejiga.
- Excluidos o con restricciones para la inclusión:
- Pacientes con cáncer curable extendido o metastásico (como cáncer testicular o linfoma), deberán esperar entre 1 y 3 años sin evidencia de enfermedad antes de ser considerados para trasplante.
- Pacientes con cáncer de mal pronóstico (como cáncer de pulmón, estómago, cerebro, esófago, melanomas o mesoteliomas), no se recomienda trasplante antes de 5 años.
- Se desaconseja totalmente aquellos con Ca metastásico o extendido (excepto linfomas)
Infecciones
Las infecciones activas son una contraindicación para el trasplante renal por banales que sean, como una simple infección dental. Además, se deben considerar con detenimiento las siguientes:
- VIH: La infección por VIH tratada con antirretrovirales no se considera una contraindicación absoluta para el trasplante renal, siempre que el paciente cumpla con ciertos requisitos: seguimiento adecuado del tratamiento, RNA viral indetectable durante al menos 3 meses, recuento de CD4 superior a 200/uL, ausencia de infecciones oportunistas en los 6 meses previos y ausencia de complicaciones graves. Sin embargo, los receptores VIH positivos presentan una mayor tasa de rechazo agudo, quizá no debido a la propia enfermedad, sino a los medicamentos de uso crónico.
- Tuberculosis: La tuberculosis debe ser investigada de manera protocolizada antes del trasplante, ya que puede permanecer asintomática hasta que se inicie el tratamiento inmunosupresor. En caso de diagnóstico positivo, se debe iniciar tratamiento completo antes de proceder con el trasplante.
- CMV (Cytomegalovirus): La infección por CMV presenta un riesgo elevado de morbimortalidad en receptores seronegativos cuando el donante es seropositivo. Es crucial realizar un seguimiento adecuado y, si es necesario, tratar la infección antes del trasplante para reducir los riesgos postoperatorios.
- Hepatitis B: Los pacientes portadores de HBsAg con replicación vírica activa (HBeAg positivo, DNA polimerasa positivo o Delta positivo) deben esperar hasta haber recibido tratamiento y haber mostrado una respuesta favorable antes de ser considerados para el trasplante. El tratamiento antiviral debe comenzar al menos una semana antes del inicio de la inmunosupresión, con medicamentos como entecavir o tenofovir, que han demostrado ser eficaces para reducir el riesgo de reactivación. Además, se recomienda vacunar a todos los pacientes con enfermedad renal crónica contra la hepatitis B.
- Hepatitis C: En pacientes con hepatitis C, los inmunosupresores no interfieren significativamente con los antivirales de acción directa, excepto en algunas combinaciones específicas que requieren ajustes en las dosis de los inmunosupresores. Se recomienda tratar la hepatitis C antes del trasplante renal, usando los nuevos antivirales sin interferón. Los pacientes infectados por VHC que ya han recibido el trasplante renal también deben ser tratados con antivirales de acción directa. Recordar que pacientes con cirrosis avanzada pueden no ser candidatos a trasplante renal aislado sino doble hepatorrenal.
2.3.3 Pruebas diagnósticas
Los pacientes en evaluación para trasplante renal deben someterse a un conjunto de pruebas diagnósticas que incluyen estudios analíticos, serológicos y de imagen, con el objetivo de descartar contraindicaciones, evaluar comorbilidades y optimizar su pronóstico postrasplante.
En la siguiente tabla se resumen todas las pruebas diagnósticas de interés:
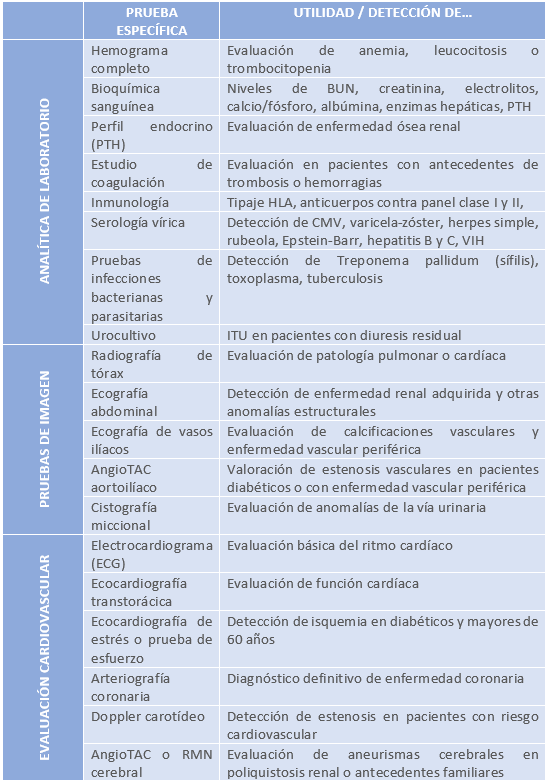
Tabla 4: Resumen de las pruebas diagnósticas en el paciente candidato a trasplante renal
2.3.4 Pacientes altamente inmunizados
Como ya sabemos, el trasplante renal en pacientes con anticuerpos anti-HLA específicos contra el donante (DSA, Donor-Specific Antibodies) conlleva un mayor riesgo de rechazo mediado por anticuerpos, tanto en fases tempranas como crónicas, lo que puede comprometer la supervivencia del injerto a medio y largo plazo. Por esta razón, siempre que sea posible, se recomienda realizar un trasplante con compatibilidad HLA, es decir, sin la presencia de DSA, para optimizar los resultados postrasplante.
No obstante, en un número creciente de pacientes altamente sensibilizados, esto no siempre es viable, incluso con estrategias de priorización o donación cruzada. El trasplante renal en pacientes altamente inmunizados representa uno de los mayores desafíos en la medicina de trasplantes. Estos pacientes presentan una elevada presencia de anticuerpos preformados contra antígenos HLA, lo que incrementa el riesgo de rechazo hiperagudo y disminuye las oportunidades de recibir un injerto compatible. A lo largo de los años, como veremos a continuación, se han desarrollado diversas estrategias para mejorar el acceso al trasplante en este grupo de pacientes y optimizar la supervivencia del injerto.
El Programa PATHI es una iniciativa en España diseñada para mejorar el acceso al trasplante renal en pacientes altamente inmunizados, es decir, aquellos con un Panel de Anticuerpos Reactivos (PRA) superior al 98%, lo que dificulta encontrar un donante compatible. De este modo, busca reducir los tiempos de espera en lista de trasplante para estos pacientes, optimizando la asignación de órganos mediante un sistema de priorización en la ONT, minimizando así el riesgo de rechazo seleccionando donantes con menor incompatibilidad HLA.
Desde su implementación, PATHI ha permitido que un mayor número de pacientes altamente inmunizados accedan al trasplante renal con mejores tasas de éxito. Ha reducido significativamente el tiempo en lista de espera y ha mejorado la supervivencia del injerto al optimizar la compatibilidad donante-receptor.
En cada centro autorizado para la realización de trasplante renal, un equipo multidisciplinar, formado por nefrólogos e inmunólogos, debe revisar los posibles candidatos a delisting, que es la no consideración de ciertos antígenos HLA prohibidos con el fin de poder facilitar el acceso al trasplante. El paciente debe ser informado de esta estrategia, por lo que él deberá asumir si está dispuesto a asumir ese riesgo de mayor rechazo hiperagudo y de incrementar las cargas inmunosupresoras para el mantenimiento del injerto, o bien mantenerse en lista de espera con remotas posibilidades de recibir dicho órgano. Es necesario considerar el tipo de paciente:
- PRAc del 100% (>99,5%): valorar el delisting desde el inicio. Se comenzará por un delisting de bajo riesgo
- PRAc del 99 y 98%: En estos pacientes, se considerará el delisting tras una permanencia mínima en los programas de intercambio superior a dos años.
Por tanto, el objetivo del delisting es lograr ofertas de riñón de donante fallecido, asumiendo la presencia de DSA, pero tratando de minimizar el riesgo. Se debe intentar realizar un procedimiento de delisting gradual, considerando primero la eliminación de antígenos HLA prohibidos reconocidos por Ac menos deletéreos. Por tanto, el orden ideal sería:
- Delisting de bajo riesgo: destinado a pacientes con PRAc del 100% con múltiples sensibilidades pero baja MFI, PRAc del 98 y 99% en igual condición y que lleven más de 2 años, u otros hiperinmunizados con necesidad de trasplante urgente. Se recomienda comenzar el delisting centrado en un único gen, a ser posible de menor MFI.
- Delisting de alto riesgo: aumenta el riesgo de rechazo e inmunosupresión, permitiendo MFI de intensidad intermedia. Se flexibilizan estos criterios para los pacientes anteriormente nombrados que no han tenido oportunidad de ser trasplantados.
Por su parte, los tratamientos empleados en la desensibilización de pacientes hiperinmunizados son los siguientes:
- Eliminación de anticuerpos mediante plasmaféresis o inmunoadsorción.
- Inhibición de la producción de anticuerpos:
- Agentes antilinfocitos B: rituximab (anti-CD20).
- Inhibidores de células plasmáticas: bortezomib (inhibidor del proteasoma).
- Inhibición de la cascada del complemento: eculizumab (anti-C5a).
- La administración de inmunoglobulina intravenosa (IVIG) tiene múltiples efectos sobre diferentes vías inmunológicas, como neutralización de los anticuerpos anti-HLA circulantes, inhibición de la activación del complemento, inhibición de la expresión de CD19 en linfocitos B activados, efectos inhibitorios sobre la inmunidad celular…
- Esplenectomía: eliminación de una fuente importante de linfocitos, incluidas células B productoras de anticuerpos, precursores de células B y células plasmáticas.
- Imlifidasa: capaz de degradar las IgG humanas, evitando la activación del complemento y toxicidad celular dependiente de anticuerpo. Su principal beneficio respecto a tratamientos desensibilizadores previos reside en su rapidez de actuación y está destinado a pacientes con mayor permanencia en lista de espera.
2.3.5 Exclusión de la lista de espera de trasplante renal
El incremento en la supervivencia y calidad de vida asociado al trasplante renal justifica una evaluación exhaustiva para identificar y abordar posibles factores que podrían desaconsejar la inclusión de un paciente en lista de trasplante.
La edad, por sí sola, nunca constituye una contraindicación para el trasplante renal. Del mismo modo, ninguna nefropatía de base representa una contraindicación absoluta, aunque algunas pueden implicar un peor pronóstico vital, menor supervivencia del injerto o mayor riesgo de recidiva.
El objetivo principal del estudio del receptor debe ser facilitar el trasplante, no desaconsejarlo. No obstante, existen excepciones a esta norma general:
- Condiciones quirúrgicas y técnicas: Cualquier condición que contraindique una cirugía prolongada bajo anestesia general, así como la imposibilidad técnica de realizar el implante renal con garantías.
- Patologías cardiovasculares y respiratorias: Cardiopatía isquémica aguda o crónica sintomática, no controlada, sin posibilidad de revascularización, insuficiencia cardiaca congestiva con fracción de eyección <30% y EPOC severo a pesar del tratamiento.
- Enfermedades hepáticas: Insuficiencia hepática crónica avanzada sin posibilidad de trasplante hepático previo o doble simultáneo, así como hepatitis crónica activa por VHC que requiera tratamiento con interferón, posponiendo el trasplante hasta su finalización.
- Infecciones: Infección viral, bacteriana o parasitaria aguda y/o no controlada. Para pacientes con infección por VIH, en los casos previamente descritos.
- Neoplasias: Neoplasia activa no controlada (casos previamente descritos)
- Factores psicosociales: incapacidad del paciente o su entorno para adherirse al tratamiento postrasplante, incluyendo la medicación y las visitas de seguimiento.
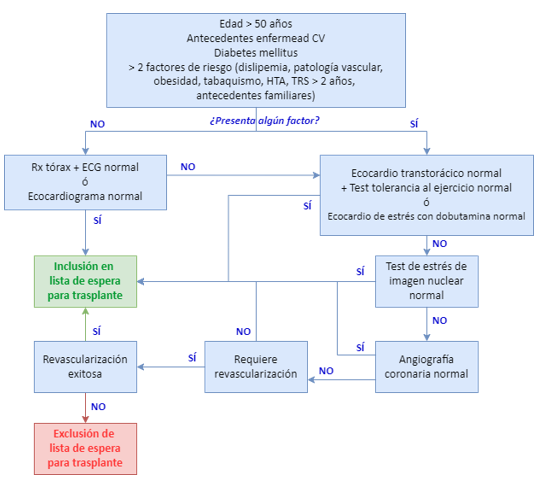
Ilustración 27: Algoritmo de decisión de inclusión o exclusión del paciente en lista de espera para trasplante renal en función de factores de riesgo y pruebas diagnósticas. Fuente: modificado de Pérez-Tamajón L y Hernández-Marrero D, 2024; disponible en: https://nefrologiaaldia.org/es-articulo-evaluacion-del-receptor-de-trasplante-renal-62
2.4 Evaluación del donante
La evaluación del donante es un proceso crítico en el trasplante renal, ya que su idoneidad afecta directamente la viabilidad del injerto y la seguridad del propio donante. El objetivo es garantizar la compatibilidad inmunológica, minimizar riesgos quirúrgicos y prevenir la transmisión de enfermedades al receptor. Siempre se debe asegurar la seguridad del donante, de modo que no afecte a su salud significativamente en el largo plazo, así como la compatibilidad inmunológica y prevención de transmisión de enfermedades, cuestiones varias que podrían afectar al receptor y causarle un perjuicio mucho mayor que el beneficio que a priori le daría el trasplante.
Básicamente, los donantes los podemos clasificar en vivos o fallecidos, y a su vez:
Donante vivo:
- Relacionados: familiares de primer o segundo grado donde se asegura la compatibilidad inmunológica
- Donación cruzada: intercambio de órganos entre parejas donde los miembros son incompatibles entre sí, pero compatibles con uno de los miembros de otra pareja, la cual también se beneficia del proceso
Donante fallecido:
- Donante en muerte encefálica (ME): Principal fuente de órganos, con mejor preservación renal.
- Donante en asistolia (DA): Procedente de parada cardiorrespiratoria, con mayor riesgo de lesión isquémica del injerto.
La selección adecuada del donante es esencial para optimizar la supervivencia del injerto y minimizar riesgos tanto en el receptor como en el donante. La viabilidad del injerto siempre será mayor cuando el donante es vivo que cuando procede de cadáver, y este cuando procede de paciente en muerte encefálica a asistolia. A lo largo del capítulo desarrollaremos en profundidad estos conceptos.
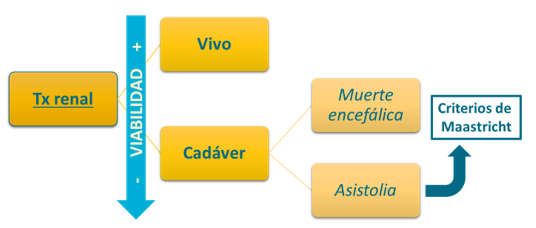
Ilustración 28: Viabilidad del injerto según donante
Puesto que la demanda de trasplantes ha crecido de forma paulatina, se hace imprescindible la “flexibilización” con garantías de las condiciones en las que se realiza el trasplante. Sin embargo, no por ello debemos olvidar de la existencia de unos criterios absolutos y ampliados (antes contraindicación relativa; ahora simple factor a considerar) de exclusión del donante, que exponemos en la siguiente tabla:

Tabla 5: Criterios de exclusión absolutos y de inclusión ampliados del donante vivo
En relación a la edad, con el fin de respetar la autonomía del paciente, no es posible realizar donaciones por individuos vivos menores de 18 años. Sin embargo, también cabría plantearse las edades máximas. Si bien es cierto que se han llegado a trasplantar riñones de pacientes de longeva edad, la realidad es que el paso del tiempo hace mella en el parénquima renal y supone una disminución del número total de nefronas. Es por eso que la tendencia es a trasplantar riñones de donante de avanzada edad a receptores con similares características, puesto que se espera que la esperanza de vida sea más corta. Pero, en resumen, lo importante no es como tal la edad, sino la función renal residual (se esperan valores por encima de 60-70 ml/min) y la morfología micro/macroscópica (valoración de glomérulos, túbulos, vasos e intersticio) de los riñones.
La hipertensión arterial y la diabetes son factores determinantes en la selección de donantes renales, ya que pueden comprometer la masa nefronal y aumentar el riesgo de fallo del injerto. El concepto de donante con criterio expandido surge para identificar aquellos riñones con mayor riesgo de disfunción, incluyendo donantes con HTA o antecedentes de muerte por accidente cerebrovascular. En el caso de la diabetes, su impacto en la función renal depende del grado de afectación vascular y glomerular. Aunque la nefropatía diabética avanzada contraindica la donación, los riñones de donantes diabéticos sin proteinuria y con función renal conservada pueden ofrecer resultados satisfactorios. Para estos casos, es fundamental evaluar parámetros como la microalbuminuria y la glomeruloesclerosis en la biopsia pretrasplante. Cuando la función renal está reducida, se pueden adoptar estrategias como la asignación a receptores de mayor edad o el trasplante doble. En definitiva, la evaluación rigurosa de estos donantes permite maximizar el aprovechamiento de órganos sin comprometer la seguridad del receptor.
El fracaso renal agudo en donantes no contraindica la donación, ya que suele ser reversible. Este deterioro puede deberse a trastornos hemodinámicos asociados a la muerte encefálica o al uso de ciertos fármacos en la UCI. Si se confirma que la insuficiencia renal es aguda, la extracción puede realizarse. La evaluación macroscópica y la histología del injerto determinarán su viabilidad. La presencia de necrosis tubular, sin necrosis cortical, permite el trasplante con buenos resultados. Experiencias clínicas han demostrado que riñones de donantes con FRA, incluso con niveles elevados de creatinina (2-9 mg/dl), pueden ofrecer una función adecuada tras el trasplante. Por ello, un diagnóstico preciso y la evaluación post extracción son clave para optimizar el uso de estos órganos.
También surge el dilema de aceptar o descartar riñones con alteraciones estructurales que aún no han provocado insuficiencia renal. Se han trasplantado con éxito órganos con poliquistosis renal del adulto en fase funcional normal, hemosiderosis o glomerulonefritis mesangial sin deterioro renal. Además, en algunos casos excepcionales, se ha logrado reutilizar un injerto previamente trasplantado tras el fallecimiento precoz del primer receptor, demostrando la viabilidad de estrategias innovadoras en la optimización de órganos disponibles.
Finalmente, aunque los donantes con VIH son descartados, los portadores de los virus B y C de la hepatitis pueden ser considerados si los receptores también son portadores de estos virus. Los riñones de donantes con antígeno de superficie del virus B (AgHBs+) pueden trasplantarse en receptores AgHBs+, siempre que no haya infección por el virus delta, obteniendo buenos resultados y reduciendo los tiempos de espera. Además, los antivirales actuales han disminuido la morbimortalidad asociada a la hepatitis B. En el caso del virus C, estudios han demostrado que los injertos de donantes con anticuerpos anti-VHC pueden utilizarse en receptores con PCR positiva para VHC sin aumentar la mortalidad ni la morbilidad. Esta estrategia contribuye a optimizar la disponibilidad de órganos y mejora el acceso al trasplante en pacientes infectados.
2.4.1 Donante vivo
La principal indicación que presenta el trasplante renal de donante vivo es la de actuar como terapia renal sustitutiva, al igual que los tratamientos de diálisis. Sin embargo, cuando este trasplante se hace de modo anticipativo, el permite evitar las complicaciones de la diálisis y ofrece mejores resultados en la función renal a largo plazo. Así, ciertos pacientes, como aquellos en los que no es posible obtener un riñón de cadáver a tiempo (por el simple hecho de no haber donante), aquellos que cuentan con un hermano de idéntico HLA, o finalmente aquellos hiperinmunizados con prueba cruzada negativa son los que más beneficiados se podrían ver de este tipo de trasplante.
Por supuesto, la donación de un órgano -riñón en este caso- es un proceso que debe ser altruista y bajo ningún tipo de coerción; tanto es así, que la compensación monetaria o de cualquier otro tipo objetivable está tipificada como delito. Por supuesto, los principios bioéticos de autonomía y no maleficencia se anteponen a la beneficencia del supuesto receptor.
Cuando aparece un posible donante (ya sea familiar o altruista sin relación ni parentesco lo que se conoce como donante samaritano-) se lleva a cabo el siguiente protocolo:
- Entrevista con el donante: se provee de información sobre los riesgos existentes, beneficios y resultados posibles. Se deben conocer antecedentes clínicos del donante y detectar aquellos que contraindiquen la donación (procesos oncológicos, diabetes, enfermedades de transmisión sanguínea…), así como las características clínicas del receptor que puedan comprometer la viabilidad del injerto, si es que estas todavía no se conocen.
- Examen inmunológico: en primer lugar, como ya hemos explicado, es importante conocer la compatibilidad AB0 de donante-receptor. Si esta es adecuada, se procede al tipaje HLA, detección de anticuerpos (para lo cual es muy importante conocer los antecedentes previos) y realizar así la prueba cruzada inicial.
- Otras pruebas complementarias: además de las biometrías de los pacientes es importante una batería de pruebas diagnósticas como la que estudiamos en el capítulo anterior (análisis de sangre, pruebas de imagen…).
- Revisión urológica, valoración psicológica y visita pre anestésica: servirá para el estudio específico de estructuras urinarias, de si los pacientes se encuentran en total disposición de sus facultades intelectuales y afectivas de modo que no haya podido presionar o comprometer el proceso de donación, y si son óptimos para someterse a una cirugía de tal entidad, respectivamente.
- Prueba cruzada definitiva: puesto que este proceso se puede demorar en el tiempo, se hace importante tener lo más cercano posible a la intervención la prueba cruzada definitiva
- Presentación ante el Comité de Ética Asistencial: tales organismos desempeñan un papel clave en la evaluación de los trasplantes de donantes vivos, actuando como garantes de la ética y transparencia en los trasplantes de donante vivo, contribuyendo a la protección de los derechos de todas las partes implicadas. Algunos de los aspectos más importantes de su actuación se centran en:
- Evaluar la autonomía y voluntariedad del donante: Verifican que la donación se realice de manera voluntaria, informada y sin coacción, asegurando que el donante ha comprendido los riesgos y beneficios del procedimiento y analizan posibles presiones externas, tanto familiares como sociales o económicas, que pudieran influir en la decisión.
- Valorar los principios bioéticos: por un lado, de beneficencia y no maleficencia (evalúan el equilibrio entre los riesgos y beneficios para el donante y el receptor y garantizan que se cumplan los criterios médicos y psicológicos para minimizar riesgos en el donante); por otro, de autonomía (confirman que el donante ha recibido una información clara y suficiente sobre el procedimiento, riesgos y alternativas, y evalúan la capacidad del donante para tomar una decisión libre de sesgos o manipulaciones); y también de justicia (aseguran de que la donación no favorezca prácticas discriminatorias ni implique incentivos económicos ilegales y supervisan que el acceso al trasplante se realice bajo criterios médicos y no por factores externos).
- Casos de especial complejidad: Intervienen en situaciones donde hay dudas éticas, como donaciones entre personas sin relación familiar, donaciones cruzadas o casos de incompatibilidad inmunológica con técnicas de desensibilización. También participan en la valoración de donaciones en menores emancipados o en casos en los que la decisión del donante pueda estar influenciada por situaciones de vulnerabilidad.
- Presentación ante el Registro Civil: La prestación del consentimiento por parte del donante ha de realizarse ante el Juez encargado del Registro Civil del lugar de la intervención en presencia del médico que certificó sobre su estado de salud y circunstancias, del médico responsable del trasplante, y de la persona que da conformidad a la práctica de la intervención. Con el fin de constatar que el consentimiento del donante es serio, meditado y mantenido, el legislador establece un plazo mínimo de 24 horas entre la autorización y la extracción durante el cual podrá revocarse dicho consentimiento. Obviamente podrá, de igual manera, dejarse sin efecto hasta el mismo momento de la intervención.
Aunque el riesgo de complicaciones mortales en los donantes vivos está muy reducido debido al avance de la medicina y al manejo de posibles infecciones oportunistas, se trata de un procedimiento que no está libre de riesgo. Así, varios estudios apuntan a que el riesgo de mortalidad operatoria se sitúa en torno al 0,01 - 0,03%. Otras complicaciones relacionadas con la técnica quirúrgica empleada son, por orden de prevalencia, el neumotórax, lesiones de peritoneo o asa intestinal, hemorragias, infecciones de tipo urinario, respiratorio o de la propia herida quirúrgica, embolismo pulmonar, necesidad de reintervención quirúrgica y herniación, entre otras mucho menos prevalentes. Más aún, en el largo plazo existe un riesgo añadido en el individuo donante de desarrollar hipertensión arterial, proteinuria e, incluso, insuficiencia renal crónica, con requerimiento de terapia renal sustitutiva.
El Registro Español de Trasplante renal con Donante Vivo (ReTReVi) recoge de manera sistemática información sobre el estudio de los donantes en vida de un riñón, la cirugía que posibilita la donación (nefrectomía) y del seguimiento postdonación. El registro nacional de donante vivo renal se puso en marcha en España en el año 2010, mediante una plataforma a disposición de todos los equipos de trasplante renal español, con los siguientes objetivos:
- Conocer la epidemiología de los donantes de un riñón en vida y el tipo de relación que mantienen con los receptores.
- Conocer la epidemiología de la técnica de nefrectomía de donante vivo empleada en nuestro país y su índice de complicaciones.
- Conocer las posibles implicaciones clínicas y psicosociales de la donación renal a corto, medio y largo plazo.
- Fomentar y servir de base para la realización de estudios epidemiológicos y otras investigaciones científicas.
- Informar sobre los datos epidemiológicos de la donación renal en vida a nivel nacional a todos los participantes en el registro, y a las autoridades sanitarias autonómicas, nacionales e internacionales, así como al público interesado en general.
- Publicar la información periódicamente en esta plataforma para permitir un acceso rápido a esa información, lo más actualizada posible.
Donación cruzada
La donación cruzada es una estrategia que permite trasplantes renales entre parejas donante-receptor incompatibles, intercambiando órganos con otras parejas en la misma situación. Este mecanismo es especialmente útil cuando el donante no es compatible con su receptor por incompatibilidad de grupo sanguíneo o presencia de anticuerpos preformados contra el HLA del receptor.
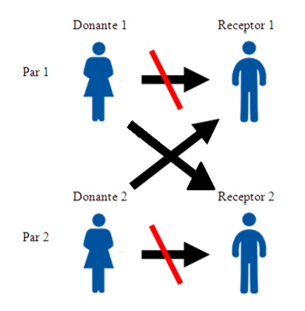
Ilustración 29: Ejemplo de donación cruzada. Fuente: Gautos A et al. 2017; disponible en: https://www.revistarenal.org.ar/index.php/rndt/article/view/88/503
El procedimiento consiste en la identificación de parejas incompatibles y su inclusión en un programa de donación cruzada, donde un sistema algorítmico busca combinaciones óptimas para maximizar la compatibilidad. La donación cruzada mejora el acceso al trasplante en pacientes sensibilizados y reduce los tiempos de espera. Además, se asocia a mejores resultados de supervivencia en comparación con los trasplantes de donante fallecido, al permitir la optimización de la compatibilidad inmunológica. Su implementación requiere coordinación entre centros y marcos legales adecuados.
En España, el Programa Nacional de Donación Renal Cruzada se sustenta en dos registros principales: uno, el de la red de hospitales que está adscrita al programa; otro, un registro nacional de parejas donante-receptor, cuya función es la de recopilar la información necesaria para la valoración clínica e inmunológica de las parejas, así como facilitar e identificar las combinaciones posibles en el intercambio.
La información recogida es similar a la expuesta a lo largo de este documento, basada en el historial y antecedentes médicos, condiciones hemato-inmunológicas para el estudio de compatibilidad de grupos y HLA… A su vez, la inclusión en el programa de donación cruzada será siguiendo el siguiente algoritmo facilitado por la ONT:
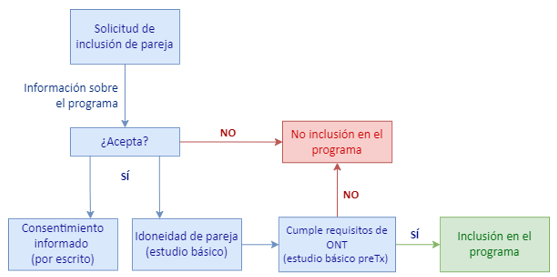
Ilustración 30: Algoritmo de inclusión en el programa de donación cruzada. Fuente: modificado de ONT
Donación altruista
El donante altruista, también denominado "buen samaritano", es aquella persona que decide donar un órgano a un receptor desconocido que requiere un trasplante. La aceptación de esta modalidad desde la bioética exige el cumplimiento de criterios rigurosos que garanticen tanto el éxito del procedimiento como la seguridad del donante.
Dado el carácter excepcional de esta donación, es fundamental una evaluación psicológica exhaustiva que analice las motivaciones del candidato, asegurando que su decisión sea completamente desinteresada y libre de influencias externas. No solo debe descartarse cualquier incentivo económico, sino también la búsqueda de reconocimiento o promoción personal. La solidez emocional, el respaldo familiar y una estabilidad económica adecuada son factores clave en esta evaluación, así como el mantenimiento del anonimato entre donante y receptor.
La ONT, en colaboración con el comité de expertos en trasplante renal cruzado, ha establecido un protocolo detallado para evaluar a los candidatos. Este proceso incluye valoraciones psicosociales y médicas, la intervención de un comité de ética y la presentación de documentación ante la autoridad judicial, garantizando un procedimiento seguro y éticamente sólido.
El protocolo establece una evaluación rigurosa del donante para garantizar su seguridad y la ética del procedimiento.
- Coordinación y evaluación inicial: Todas las solicitudes se comunican a la ONT, que designa un hospital autorizado para la primera evaluación. Se realiza una historia clínica, exploración física y análisis de sangre, además de una entrevista sobre la motivación, apoyo familiar y situación socioeconómica del donante.
- Evaluación avanzada: Para realizar la evaluación de un potencial donante altruista, trabajarán dos tipos de centros.
- Hospital de referencia designado en Comunidad Autónoma: se realiza una primera valoración más encaminada a aspectos socioeconómicos y psicológicos del donante. Si la primera evaluación es favorable, un segundo hospital realiza una valoración más profunda.
- Hospital encargado del seguimiento del trasplante: Se encarga de valoración médica integral, incluyendo pruebas de compatibilidad y riesgos quirúrgicos. También mantiene una entrevista final con el equipo de trasplantes para confirmar la decisión. - Validación ética y legal: El informe se remite a un Comité de Ética que aprueba o rechaza la donación. Se requiere una declaración judicial del donante para garantizar su consentimiento informado.
- Inclusión y trasplante: El donante entra en el Programa Nacional de Donación Renal Cruzada, donde su riñón se asigna para maximizar el número de trasplantes posibles. El trasplante se lleva a cabo manteniendo el anonimato entre donante y receptor. Un aspecto importante a aclarar es que, en caso de que el riñón no fuera posible injertarlo en el receptor, una vez extraído, este no se devolverá al cuerpo del donante por el alto riesgo respecto al beneficio que esto supone para el donante vivo.
- Seguimiento postrasplante: El hospital responsable realiza el seguimiento del donante, evaluando su estado de salud a corto y largo plazo. La ONT registra la evolución del donante y del receptor para asegurar la calidad del proceso.
2.4.2 Donante fallecido
El trasplante renal de donante fallecido es la principal fuente de órganos en la mayoría de los sistemas de trasplantes a nivel mundial. Su importancia radica en la posibilidad de ofrecer una opción terapéutica a un gran número de pacientes con insuficiencia renal terminal, reduciendo la dependencia de la diálisis y mejorando la calidad de vida y la supervivencia. La selección del donante fallecido sigue criterios estrictos para minimizar riesgos en el receptor, evaluando aspectos inmunológicos, infecciosos y anatómicos. Además, en ciertos casos se emplean riñones con criterios expandidos (anteriormente comentados), optimizando la disponibilidad de órganos sin comprometer la seguridad del trasplante.
Existen dos tipos de donantes fallecidos: donante en muerte encefálica (ME) y donante en asistolia (DA).
Donación en muerte encefálica
La muerte encefálica (ME) es un estado irreversible de cese total de la función cerebral, incluyendo el tronco encefálico, lo que equivale a la muerte del individuo desde el punto de vista médico y legal. Su reconocimiento es fundamental en el ámbito de los trasplantes, ya que permite la obtención de órganos viables para donación en condiciones óptimas.
La ME ocurre cuando existe un daño cerebral catastrófico que provoca una isquemia global e irreversible del encéfalo, llevando a la pérdida definitiva de todas sus funciones. Algunas de las causas más frecuentes son los traumatismos craneoencefálicos graves, hemorragias intracraneales masivas, o hipoxia severa por parada cardiorrespiratoria prolongada, entre otros. A diferencia del coma profundo o del estado vegetativo, en la muerte encefálica no hay posibilidad de recuperación, ya que la lesión interrumpe de manera permanente la actividad neuronal.
El diagnóstico de ME se basa en una evaluación clínica rigurosa, complementada con pruebas instrumentales en caso necesario. Se deben cumplir tres criterios fundamentales:
- Coma mantenido: Pérdida irreversible del estado de conciencia y ausencia de respuestas a estímulos externos.
- Ausencia de reflejos del tronco encefálico: Se evalúan reflejos pupilares, corneanos, oculocefálicos, oculovestibulares, tusígeno y faríngeo.
- Ausencia de respiración espontánea: Se realiza la prueba de apnea, que demuestra la incapacidad del paciente para generar movimientos respiratorios en respuesta a la hipercapnia.
La hipotensión arterial brusca es típica al final del proceso de isquemia cerebro-espinal progresiva y herniación del troncoencéfalo. Se requiere siempre prudencia, competencia y rigor. Otras características que acompañan a la ME son hipotermia, alteraciones hidroelectrolíticas, coagulopagías, arritmias y edema de pulmón neurogénico.
Antes de iniciar el protocolo de diagnóstico, es fundamental descartar factores confusionales, como hipotermia, alteraciones metabólicas graves o intoxicaciones farmacológicas, que puedan simular un cuadro neurológico similar. Es decir, deben evitarse las valoraciones neurológicas en caso de que el potencial donante se encuentre en esta situación.
Cuando existen dudas en el diagnóstico clínico, pueden emplearse pruebas complementarias, como electroencefalograma (EEG), doppler transcraneal, angiografía cerebral o estudios de perfusión cerebral, los cuales confirman la ausencia total de actividad neuronal. Dichas pruebas son confirmatorias o auxiliares, no pruebas diagnósticas de ME. Es importante resaltar que retrasar una declaración de ME debido únicamente a una prueba de confirmación negativa es considerada una mala práctica clínica y tiene poca justificación.
La viabilidad de los riñones para trasplante se realizará en base a su función renal basal y al ingreso (observar aclaramiento de creatinina), estructura y perfusión. Si la función renal basal y al ingreso es normal la viabilidad de los riñones podrá ser realizada a partir de la evaluación macroscópica peroperatoria (tamaño y color adecuado; ausencia de lesiones parenquimatosas y vasculares relevantes) y de la perfusión renal.
En cuanto al mantenimiento del donante adulto en ME para la preservación de órganos se basa en el soporte hemodinámico y ventilatorio, que debe ser intensivo y continuo desde el establecimiento del diagnóstico hasta la extracción de los órganos. Los objetivos más importantes del mantenimiento vienen recogidos en la siguiente tabla:
Tabla 6: Objetivos más importantes del mantenimiento de órganos y medidas a implementar
Finalmente debemos remarcar que la función renal en el donante tiene un alto riesgo de deteriorarse de forma aguda durante la evolución a muerte encefálica y durante el mantenimiento debido a todos los fenómenos anteriormente descritos. El objetivo es buscar una diuresis horaria cercana a 100 ml/h, mejorando así las perspectivas de supervivencia del injerto.
Donación en asistolia
La donación en asistolia (DA), también conocida como donación tras parada cardiorrespiratoria, se basa en la obtención de órganos de pacientes que han sufrido una parada cardiorrespiratoria irreversible. El diagnóstico de muerte por criterios circulatorios y respiratorios se basará de forma inequívoca en la ausencia de circulación y de respiración espontánea durante un período no inferior a cinco minutos.
Ante la cada vez mayor demanda de trasplantes, es una estrategia cada vez más utilizada para aumentar la disponibilidad de órganos en trasplante. En la siguiente imagen se muestra el número relativo de trasplantes por tipo de donante hasta 2023. Durante el 2024 el 51% de los donantes en nuestro país fueron donantes en asistolia, según la nota de prensa del Ministerio de Sanidad, pero aún no se ha publicado el informe definitivo.
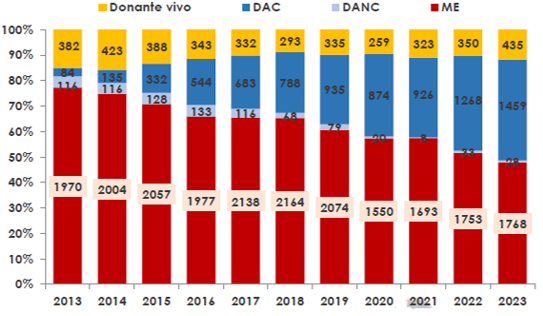
Ilustración 31: Número absoluto y porcentaje relativo de trasplantes por tipo de donante hasta 2023. DAC: Donación en asistolia controlada; DANC: Donación en asistolia no controlada; ME: muerte encefálica. Fuente: ONT
El trasplante renal, principal protagonista en general del trasplante en España por ser el que más se da, también se ha visto beneficiado del desarrollo de la donación en asistolia debido a una serie de consideraciones que veremos más adelante.
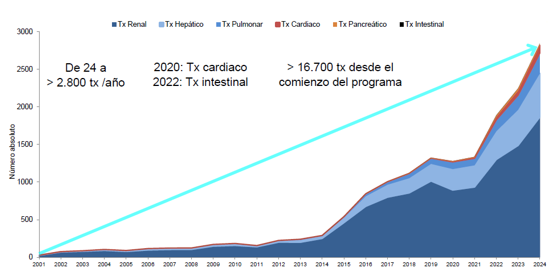
Ilustración 32: Evolución del número total de trasplantes en asistolia en nuestro país. Fuente: ONT
A diferencia de la donación en ME anteriormente comentada, donde la circulación y la oxigenación se mantienen mediante soporte ventilatorio hasta la extracción de órganos, en la DA la actividad cardíaca cesa antes de la extracción, lo que implica desafíos en la viabilidad de los injertos. Debido a la implicación que genera la asistolia en la disminución de perfusión de órganos, y su daño incrementado a medida que avanza el tiempo, se establece una clasificación de estos pacientes en función de la Clasificación de Maastricht:
Donación en asistolia no controlada (DANC)
- Tipo I: Parada cardíaca extrahospitalaria no controlada. Pacientes que sufren una parada cardiorrespiratoria fuera del hospital. No se realizan maniobras al sospechar de un periodo demasiado prolongado como para realizar RCP.
- Tipo II: Parada cardíaca intrahospitalaria no controlada. Pacientes que sufren una parada cardíaca en el entorno extrahospitalario (IIa) o intrahospitalario (IIb) y no son recuperables.
Donación en asistolia controlada (DAC)
- Tipo III: Parada tras LSTV: Pacientes con enfermedades terminales o daño neurológico irreversible en los que se decide la limitación del tratamiento de soporte vital (LTSV). Este es el tipo más utilizado en muchos países debido a su planificación estructurada.
- Tipo IV: Parada cardíaca en paciente en muerte encefálica: Pacientes diagnosticados de muerte encefálica que, antes de la extracción, sufren un paro cardíaco.
- Tipo V: Donación en asistolia en unidades de cuidados intensivos: Resucitación no exitosa en parada cardiaca inesperada en una unidad de cuidados intensivos.
El protocolo de Maastricht requiere que el diagnóstico de muerte por parada cardiaca sea realizado por un médico independiente del equipo de trasplante tras 10 minutos de cesación del masaje cardiaco externo y de la ventilación artificial.
Además de los requisitos clásicos del donante cadáver de órganos, se debe de ser bastante estricto con los tiempos de isquemia a los que han sido sometidos los órganos. Nuestros criterios y, en general, los de la mayoría de los grupos incluyen:
- Tiempo máximo de oligoanuria previo a la parada: 60 minutos (para donantes controlados). Puesto que es un poco arbitrario, se reduce a asegurarse de que no hubiera datos evidentes de insuficiencia renal aguda previa.
- Tiempo máximo de isquemia caliente (desde el inicio de la parada hasta el comienzo de la perfusión): 180 min (para donantes incontrolados). Criterio cada vez más dudoso.
- Tiempo máximo en bomba de perfusión: 240 min.
Dos conceptos claves que tenemos que conocer son los tiempos de isquemia fría y caliente, pues ayudan a entender mejor la forma de proceder. En la siguiente tabla quedan resumidas:
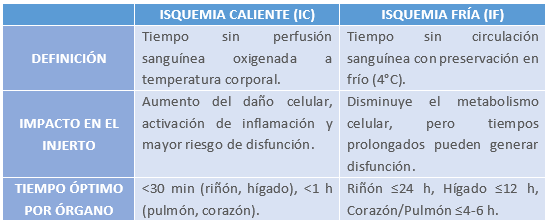
Tabla 7: Diferencias entre isquemia caliente y fría
Minimizar la isquemia caliente y optimizar la isquemia fría son estrategias clave para mejorar la supervivencia del injerto y reducir complicaciones como la disfunción primaria o el rechazo.
El manejo del donante varía de manera considerable en función de si la asistolia ha sido en condiciones controladas o no. A continuación vamos a describir cómo se procede en uno u otro contexto.
Donación en asistolia controlada
La donación en asistolia es una técnica relativamente nueva en nuestro país, y a pesar de los avances en los conocimientos sobre la materia, está muy limitada por el tiempo de isquemia caliente, pues como hemos comentado anteriormente puede dañar los órganos y hacerlos inviables, sobre todo en aquellos casos en los que la PCR se produce de forma imprevista y no se conoce el tiempo exacto de isquemia caliente.
La decisión de limitación del esfuerzo terapéutico (LET) es independiente de la posibilidad de la donación de órganos, y se realiza en las Unidades de Críticos en aquellos hospitales que dispongan de un protocolo de LET, consensuado entre los profesionales y los Comités de Ética. La retirada de las técnicas de soporte vital (ventilación mecánica, extubación, drogas vasoactivas, etc.) se realiza después de que la familia haya firmado el consentimiento para la donación. El lugar más adecuado para la desconexión de la ventilación mecánica es la Unidad de Cuidados Intensivos en la que se encuentre el paciente, aunque dependerá de cada centro, de las posibilidades para atender al paciente y a sus familiares, y del método de preservación y extracción empleadas, por lo que en ocasiones puede realizarse en quirófano.
Una vez extubado el paciente y hasta la aparición de la asistolia, tanto en el quirófano como en la UCI, deben registrarse los periodos de hipotensión, hipoxia o anuria, monitorizando constantes vitales (monitorización invasiva), así como diuresis.
Para el mantenimiento de la perfusión de órganos es imprescindible el uso de heparina sódica, así como otros fármacos e incluso hemoderivados. Pero la técnica protagonista en el mantenimiento de los injertos previa extracción es la perfusión regional normotérmica (PRN). La PRN es una estrategia clave en la donación en asistolia controlada para minimizar el daño isquémico y mejorar la viabilidad de los órganos antes de su extracción. Consiste en restablecer la circulación sanguínea de manera controlada mediante un sistema de oxigenación extracorpórea (ECMO), asegurando una adecuada perfusión de los órganos abdominales y/o torácicos sin comprometer la circulación cerebral.
La técnica de PRN puede ser:
- PRN toraco-abdominal: Se emplea en la donación cardiaca, combinando la preservación de los órganos torácicos y abdominales. Duración inferior a 90 minutos.
- PRN abdominal: Se utiliza cuando no se realiza donación cardiaca, enfocándose en los órganos abdominales. Duración algo mayor ya que el corazón tiene peor respuesta al tiempo de isquemia, por lo que se puede mantener 120 minutos.
La siguiente imagen muestra un esquema de PRN abdominal: Se canaliza la arteria radial izquierda, cánulas arterial y venosa femorales y catéter de oclusión que se coloca al nivel de la aorta torácica. Tras el exitus se llena el balón de oclusión y al iniciar la perfusión con ECMO se observa la subida progresiva de presión no pulsátil al nivel femoral y ausencia de presión al nivel radial, lo que confirma la correcta oclusión de la aorta.
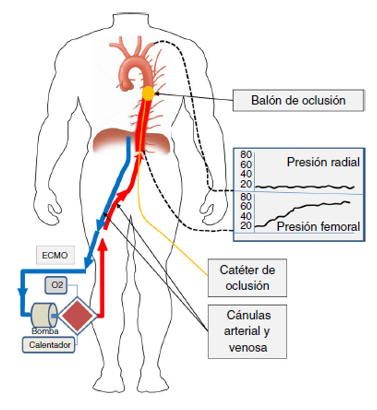
Ilustración 33: Esquema de PRN abdominal mediante ECMO. Fuente: Rubio-Muñoz JJ et al. 2022. Disponible en: https://doi.org/10.1016/j.medin.2020.01.017
Es de suma importancia en el caso de la DAC el tiempo en el que se producirá la muerte, una vez retiradas las medidas de soporte vital o tiempo de isquemia caliente, que es el factor más importante para determinar la viabilidad del órgano a trasplantar, aunque este periodo depende de las condiciones hemodinámicas o respiratorias del paciente, es decir, del tiempo que permanece en hipoperfusión. En la siguiente imagen se muestra un esquema representativo de los tiempos definidos para evitar disfunción en el injerto.
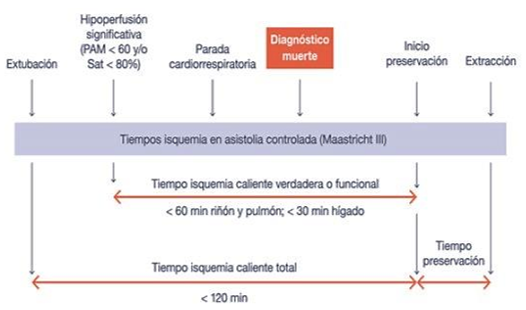
Ilustración 34: Tiempos en el proceso de donación en asistolia controlada. Fuente: Salusplay®. Disponible en: https://www.salusplay.com/apuntes/cuidados-intensivos-uci/tema-4-la-donacion-de-organos-en-asistolia
Donación en asistolia no controlada
El trasplante renal de DA no controlada se relaciona con una excelente supervivencia del injerto renal a largo plazo. Habitualmente corresponde con pacientes en categoría IIa, es decir, aquellos que ingresan en un hospital tras una parada cardíaca extrahospitalaria con resucitación infructuosa por parte de los servicios de emergencia extrahospitalarios correspondientes. Debido al carácter no controlado del fatídico evento, se hace imprescindible la existencia de un protocolo extrahospitalario de notificación de posible donante, donde se avise al centro hospitalario de referencia y coordinador de trasplantes de lo que está ocurriendo; más aún, ante la existencia de asistolia constatada, el traslado se realizará con cardiocompresión automática continua hasta su llegada al hospital, la cual se estima que debiera ser en un tiempo no superior a 120 minutos desde la parada.
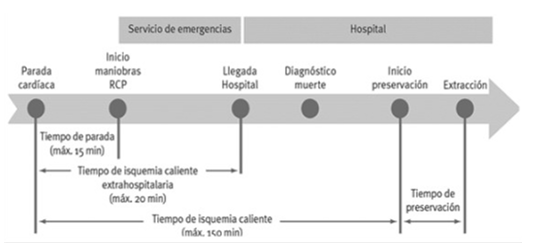
Ilustración 35: Tiempos en el proceso de donación en asistolia no controlada. Fuente: Salusplay®. Disponible en: https://www.salusplay.com/apuntes/cuidados-intensivos-uci/tema-4-la-donacion-de-organos-en-asistolia
Una vez que los riñones se han extraído, generalmente los injertos se almacenan en frío con una solución de preservación. Para ello, se requiere una solución adecuada (como la solución de Collins o de Wisconsin) que se mantendrá a una temperatura baja (entre 4 y 10°C).
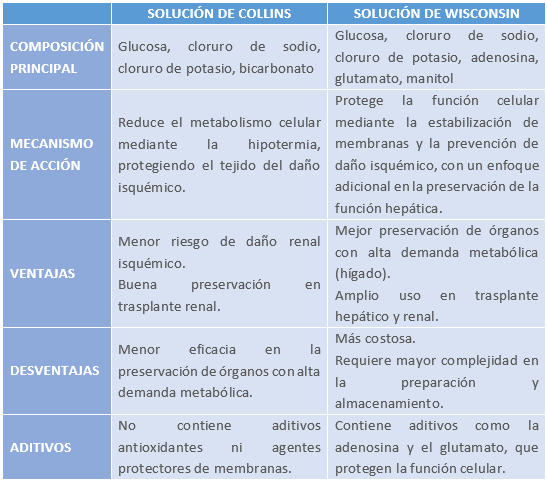
Tabla 8: Diferencias comparativas entre las soluciones de Collins y Wisconsin
Muchos programas utilizan además máquinas de perfusión pulsátil, que han mostrado ser ventajosas en este tipo de donantes.
BIBLIOGRAFÍA
- Abbas, A. K., Lichtman, A. H., & Pillai, S. (2022). Inmunología Celular Y Molecular (10a ed.). Elsevier.
- Arias, L. F. (s/f). Enf_tubulointert. Kidney Pathology. Recuperado el 2 de marzo de 2025, de https://kidneypathology.com/Enf_tubulointerst.html
- Arias, M., Campistol, J. M., & Morales, J. M. (2012). Manual de trasplante renal.
- Arrunátegui, A. M., Ramón, D. S., Viola, L. M., Olsen, L. G., & Jaramillo, A. (2022). Aspectos técnicos y clínicos de la prueba cruzada de histocompatibilidad en el trasplante de órganos sólidos. Biomedica: Revista Del Instituto Nacional de Salud, 42(2), 391–413. https://doi.org/10.7705/biomedica.6255
- Caballero, F., & Matesanz, R. (2023). ABC de la Donación y Trasplante de Órganos Humanos.
- Crespo, M., Diekmann, F., Redondo-Pachón, D., & Sancho, A. (2023). Inmunosupresión en el Trasplante Renal. Nefrologiaaldia.org.
https://nefrologiaaldia.org/es-articulo-inmunosupresion-en-el-trasplante-renal-602 - Feifer, A., & Anidjar, M. (2007). Nefrectomía laparoscópica en donante vivo. EMC - Urología, 39(4), 1–12. https://doi.org/10.1016/s1761-3310(07)70058-0
- Gutiérrez de la Fuente, C., López Jiménez, V., Pérez Flores, I., Ruíz San Millán, J. C., & Sánchez Fructuoso, A. I. (2012). Trasplante renal. En G. Fernández Fresnedo (Ed.), Algoritmos en nefrología. Grupo Editorial Nefrología.
- Halloran, P. F. (2004). Immunosuppressive drugs for kidney transplantation. The New England Journal of Medicine, 351(26), 2715–2729.
- https://doi.org/10.1056/NEJMra033540
- Kukla, A., Ventura-Aguiar, P., Cooper, M., de Koning, E. J. P., Goodman, D. J., Johnson, P. R., Han, D. J., Mandelbrot, D. A., Pavlakis, M., Saudek, F., Vantyghem, M.-C., Augustine, T., & Rickels, M. R. (2021). Transplant options for patients with diabetes and advanced kidney disease: A review. American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation, 78(3), 418–428. https://doi.org/10.1053/j.ajkd.2021.02.339
- Leeson, S., & Desai, S. P. (2015). Medical and ethical challenges during the first successful human kidney transplantation in 1954 at Peter bent Brigham hospital, Boston. Survey of Anesthesiology, 59(3), 119.
https://doi.org/10.1097/sa.0000000000000131 - Liverman, R., Chandran, M. M., & Crowther, B. (2021). Considerations and controversies of pharmacologic management of the pediatric kidney transplant recipient. Pharmacotherapy, 41(1), 77–102. https://doi.org/10.1002/phar.2483
- López Del Moral, J. L. (2010). Regulatory bases of living-donor kidney transplantation. Nefrologia: publicacion oficial de la Sociedad Espanola Nefrologia, 30 Suppl 2, 23–29.
https://doi.org/10.3265/Nefrologia.pre2010.Nov.10688 - López-Hoyos, M., Ruiz-San Millán, J. C., San Segundo-Arribas, D., & Rodrigo-Calabria, E. (2021). Inmunobiología del Trasplante. Estudios inmunológicos del donante y del receptor del trasplante renal. Nefrologiaaldia.org.
https://nefrologiaaldia.org/es-articulo-inmunobiologia-del-trasplante-estudios-inmunologicos-del-donante-y-del-146 - Matensanz, R. (2024). La pequeña - gran historia del trasplante renal en España. Grupo Editorial Nefrología de la SEN.
- Matesanz, R. (2008). El modleo español de la coordinación de trasplantes. Aula Médica.
- McAlister, V. C. (2005). Clinical kidney transplantation: a 50th anniversary review of the first reported series. American Journal of Surgery, 190(3), 485–488. https://doi.org/10.1016/j.amjsurg.2005.04.016
- Meneghini, M., Bestard, O., & Grinyo, J. M. (2021). Immunosuppressive drugs modes of action. Best Practice & Research. Clinical Gastroenterology, 54–55(101757), 101757. https://doi.org/10.1016/j.bpg.2021.101757
- Ministerio de Sanidad, Global Observatory on Donation and Transplantation, & World Health Organization. (2023). International report on organ donation and transplantation activities.
- Ministerio de Sanidad, & Organización Nacional de Trasplantes. (2011). Guía de buenas prácticas en el modelo de donación de órganos.
- Ministerio de Sanidad, Organización Nacional de Trasplantes, Sociedad Española de Trasplante, & Grupo de Histocompatibilidad. (2024). Guía Española para el Trasplante Renal en Pacientes Altamente Sensibilizados con Anticuerpos anti‑HLA Donante‑Específicos.
- Nagendra, L., Fernandez, C. J., & Pappachan, J. M. (2023). Simultaneous pancreas-kidney transplantation for end-stage renal failure in type 1 diabetes mellitus: Current perspectives. World Journal of Transplantation, 13(5), 208–220. https://doi.org/10.5500/wjt.v13.i5.208
- Organización Nacional de Trasplantes, & Ministerio de Sanidad. (2024). Informe de actividad 2024.
- Pérez-Sáez, M. J., Francés, A., & Pascual-Santos, J. (2023). Técnicas quirúrgicas en donante vivo y fallecido. Complicaciones. Indicaciones de embolización y nefrectomía del injerto. Nefrologiaaldia.org.
https://nefrologiaaldia.org/es-articulo-tecnicas-quirurgicas-en-donante-vivo-y-fallecido-complicaciones-indica-309 - Pérez-Tamajón, L., & Hernández-Marrero, D. (2024). Evaluación del receptor de trasplante renal. Nefrologiaaldia.org.
https://www.nefrologiaaldia.org/es-articulo-evaluacion-del-receptor-de-trasplante-renal-62 - Roach, J. P., Bock, M. E., & Goebel, J. (2017). Pediatric kidney transplantation. Seminars in Pediatric Surgery, 26(4), 233–240.
https://doi.org/10.1053/j.sempedsurg.2017.07.006 - Semenova, Y., Bayanova, M., Rakhimzhanova, S., Altynova, S., Sailybayeva, A., Asanova, A., & Pya, Y. (2024). Understanding pediatric kidney transplant rejection: Its pathophysiology, biomarkers, and management strategies. Current Medicinal Chemistry, 31.
https://doi.org/10.2174/0109298673333693240806160544 - Thongprayoon, C., Hansrivijit, P., Leeaphorn, N., Acharya, P., Torres-Ortiz, A., Kaewput, W., Kovvuru, K., Kanduri, S. R., Bathini, T., & Cheungpasitporn, W. (2020). Recent advances and clinical outcomes of kidney transplantation. Journal of Clinical Medicine, 9(4), 1193. https://doi.org/10.3390/jcm9041193
- Vazquez Martul, E. (2018). Anatomía patológica del trasplante renal. Revista española de patología: publicación oficial de la Sociedad española de anatomía patológica y de la Sociedad española de citología, 51(2), 110–123. https://doi.org/10.1016/j.patol.2017.10.001
- Vijayan, M., & Pavlakis, M. (2017). Pregnancy and the kidney transplant recipient. Current Opinion in Nephrology and Hypertension, 26(6), 494–500.
https://doi.org/10.1097/mnh.0000000000000363
